خبير طبي في المقال
منشورات جديدة
سرطان الرئة
آخر مراجعة: 12.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
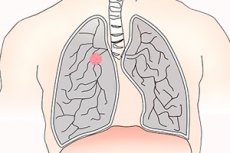
سرطان الرئة ورم خبيث يصيب الرئة، ويُصنف عادةً على أنه صغير الخلايا أو غير صغير الخلايا. يُعد تدخين السجائر عامل الخطر الرئيسي لمعظم أنواع الورم. تشمل الأعراض السعال، وألم الصدر، وبصق الدم، وهو أقل شيوعًا، إلا أن العديد من المرضى لا تظهر عليهم أعراض، وقد يُصاب بعضهم بآفات نقيلية. يُشتبه في التشخيص بتصوير الصدر بالأشعة السينية أو التصوير المقطعي المحوسب، ويُؤكد بأخذ خزعة. يشمل العلاج الجراحة والعلاج الكيميائي والعلاج الإشعاعي. على الرغم من التقدم في العلاج، إلا أن التشخيص ضعيف، ويجب التركيز على الكشف المبكر والوقاية.
الأسباب سرطان الرئة
يُعد تدخين السجائر، بما في ذلك التدخين السلبي، أهم أسباب سرطان الرئة. يعتمد الخطر على العمر وكثافة التدخين ومدته؛ وينخفض الخطر بعد الإقلاع عن التدخين، ولكنه غالبًا لا يعود إلى خط الأساس. أما بالنسبة لغير المدخنين، فإن أهم عامل خطر بيئي هو التعرض لغاز الرادون، وهو ناتج تحلل الراديوم واليورانيوم الطبيعيين. تشمل المخاطر المهنية التعرض للرادون (عمال مناجم اليورانيوم)؛ والأسبستوس (عمال البناء والهدم، والسباكين، وبناة السفن، وميكانيكي السيارات)؛ والكوارتز (عمال المناجم وعمال النفخ الرملي)؛ والزرنيخ (مصاهر النحاس، ومصنعي المبيدات الحشرية، ومصنعي منتجات وقاية النباتات)؛ ومشتقات الكروم (مصنعي الفولاذ المقاوم للصدأ والأصباغ)؛ والنيكل (مصنعي البطاريات والفولاذ المقاوم للصدأ)؛ وإيثر الكلوروميثيل؛ وانبعاثات البريليوم وأفران الكوك (لدى عمال الصلب)، والتي تُمثل عددًا صغيرًا من الحالات سنويًا. يزداد خطر الإصابة بالأورام الخبيثة في الجهاز التنفسي عند اجتماع المخاطر المهنية وتدخين السجائر مقارنةً بوجود أيٍّ منهما منفردًا. قد يزيد مرض الانسداد الرئوي المزمن والتليف الرئوي من هذا الخطر؛ كما قد تزيد مكملات بيتا كاروتين من هذا الخطر لدى المدخنين. يحتوي تلوث الهواء ودخان السيجار على مواد مسرطنة، ولكن لم يُثبت دورهما في الإصابة بسرطان الرئة.
الأعراض سرطان الرئة
حوالي 25% من حالات المرض لا تظهر عليها أعراض، وتُكتشف صدفةً أثناء فحص الصدر. تتكون أعراض سرطان الرئة من مظاهر موضعية للورم، وانتشاره في مناطق أخرى، ونقائله. يمكن أن تظهر متلازمات الأورام النظيرة الورمية والمظاهر العامة في أي مرحلة.
تشمل الأعراض الموضعية السعال، وفي حالات أقل شيوعًا ضيق التنفس الناتج عن انسداد مجرى الهواء، وانخماص الرئة التالي للانسداد، وانتشار اللمف. قد تحدث حمى مع تطور الالتهاب الرئوي التالي للانسداد. يشكو ما يصل إلى نصف المرضى من ألم صدري مبهم أو موضعي. نفث الدم أقل شيوعًا، وفقدان الدم ضئيل، إلا في حالات نادرة عندما يمزق الورم شريانًا رئيسيًا، مسببًا نزيفًا غزيرًا ووفاة بسبب الاختناق.
قد يؤدي الانتشار الإقليمي إلى حدوث ألم جنبي أو ضيق في التنفس بسبب تطور الانصباب الجنبي، وضيق في الصوت بسبب غزو الورم للعصب الحنجري الراجع، وضيق في التنفس ونقص الأكسجين بسبب شلل الحجاب الحاجز عندما يتعلق الأمر بالعصب الحجابي.
قد يُسبب ضغط أو غزو الوريد الأجوف العلوي (متلازمة الوريد الأجوف العلوي) صداعًا أو شعورًا بامتلاء الرأس، وتورمًا في الوجه أو الأطراف العلوية، وضيقًا في التنفس، واحمرارًا (زائدًا) عند الاستلقاء. تشمل أعراض متلازمة الوريد الأجوف العلوي تورم الوجه والأطراف العلوية، وتمدد الأوردة الوداجية وتحت الجلد في الوجه والجزء العلوي من الجذع، واحمرارًا في الوجه والجذع. تُعدّ متلازمة الوريد الأجوف العلوي أكثر شيوعًا لدى مرضى النوع صغير الخلايا.
قد تغزو الأورام القمية، التي عادةً ما تكون خلاياها غير صغيرة، الضفيرة العضدية أو غشاء الجنب أو الأضلاع، مسببةً ألمًا في الكتف والطرف العلوي وضعفًا أو ضمورًا في أحد الذراعين (ورم بانكوست). تحدث متلازمة هورنر (تدلي الجفن، تضيق حدقة العين، انعدام العين، وانعدام التعرق) عند إصابة السلسلة العصبية الودية حول الفقرات أو العقدة النجمية العنقية. قد يكون تمدد التامور بدون أعراض أو يؤدي إلى التهاب التامور التضييقي أو انصباب القلب. نادرًا ما يؤدي ضغط المريء إلى عسر البلع.
تُسبب النقائل دائمًا في نهاية المطاف أعراضًا مرتبطة بموقعها. تُسبب نقائل الكبد أعراضًا معدية معوية، وفي النهاية فشلًا كبديًا. تُسبب نقائل الدماغ اضطرابات سلوكية، وفقدان الذاكرة، وفقدان القدرة على الكلام، ونوبات صرع، وشلل جزئي أو كلي، وغثيان وقيء، وفي النهاية غيبوبة ووفاة. تُسبب نقائل العظام ألمًا شديدًا وكسورًا مرضية. غالبًا ما تنتقل الأورام الخبيثة في الجهاز التنفسي إلى الغدد الكظرية، ولكنها نادرًا ما تُؤدي إلى قصور كظري.
لا تُسبب السرطانات متلازمات الأورام المُصاحبة للورم مباشرةً. تشمل متلازمات الأورام المُصاحبة للورم الشائعة لدى المرضى فرط كالسيوم الدم (الناجم عن إنتاج الورم لبروتين مرتبط بهرمون الغدة جار الدرقية)، ومتلازمة الإفراز غير المناسب للهرمون المضاد لإدرار البول (SIADH)، وتعجر الأصابع مع أو بدون اعتلال عظمي مفصلي ضخامي، وفرط تخثر الدم مع التهاب الوريد الخثاري السطحي المهاجر (متلازمة تروسو)، والوهن العضلي الوبيل (متلازمة إيتون-لامبرت)، ومجموعة متنوعة من المتلازمات العصبية، بما في ذلك الاعتلالات العصبية، واعتلالات الدماغ، والتهابات الدماغ، واعتلالات النخاع، وآفات المخيخ. تتضمن آلية تطور المتلازمات العصبية العضلية تعبير الورم عن المستضدات الذاتية مع تكوين الأجسام المضادة الذاتية، إلا أن سبب معظم المتلازمات الأخرى غير معروف.
تشمل الأعراض العامة عادةً فقدان الوزن والشعور بالضيق، وتكون أحيانًا هي العلامات الأولى للورم الخبيث.
ما الذي يزعجك؟
مراحل
| الورم الأولي | |
| هذا | سرطان موضعي |
| ت1 | الورم < 3 سم بدون غزو، يقع بالقرب من القصبة الهوائية الفصية (أي ليس في القصبة الهوائية الرئيسية) |
| ت2 | ورم مع أي من السمات التالية: >3 سم يشمل القصبة الهوائية الرئيسية >2 سم بعيدًا عن الجؤجؤ يغزو غشاء الجنب الحشوي انخماص الرئة أو الالتهاب الرئوي التالي للانسداد الذي يمتد إلى القمة ولكنه لا يشمل الرئة بأكملها |
| تي زد | ورم من أي حجم مع أي من الميزات التالية: يغزو جدار الصدر (بما في ذلك آفات الثلم العلوي)، الحجاب الحاجز، الجنبة المنصفية، أو التامور الجداري. يشمل القصبة الهوائية الرئيسية < 2 سم بعيدًا عن التاج ولكن بدون إصابة التاج. انخماص الرئة أو الالتهاب الرئوي الانسدادي التالي للرئة بأكملها. |
| ت4 | ورم من أي حجم مع أي من الميزات التالية: يغزو المنصف، والقلب، والأوعية الدموية الكبرى، والقصبة الهوائية، والمريء، والجسم الفقري، والجؤجؤ. انصباب جنبي أو تاموري خبيث. عقيدات ساتلية من الأورام داخل نفس الفص مثل الورم الأساسي. |
| العقد الليمفاوية الإقليمية (N) | |
| رقم 0 | لا توجد نقائل إلى الغدد الليمفاوية الإقليمية |
| ن1 | نقائل أحادية الجانب إلى العقد الليمفاوية المحيطة بالقصبات الهوائية و/أو العقد الليمفاوية لجذر الرئة والعقد الليمفاوية داخل الرئة الواقعة على المسار المباشر لانتشار الورم الأولي |
| ن2 | نقائل أحادية الجانب إلى العقد الليمفاوية المنصفية و/أو تحت القحفية |
| ن3 | نقائل إلى العقد اللمفاوية المنصفية المقابلة، والعقد الجذرية المقابلة، والعضلة الأخمصية للعقد اللمفاوية الجانبية المقابلة أو فوق الترقوة |
| النقائل البعيدة (م) | |
| م0 | لا توجد نقائل بعيدة |
| م1 | توجد نقائل بعيدة (بما في ذلك العقد النقيلية في فصوص الجانب المقابل ولكن بخلاف الورم الأساسي) |
| المرحلة 0 Tis IA T1 N0 M0 IB T2 N0 M0 IIA T1 N1 M0 |
المرحلة الثانية ب ت2 ن 1 م0 أو ت3 ن 0 م 0 أ ت3 ن 1 م 0 أو ت 3 ن 2 م 0 أ ي ب أي ت م 0 أو ت 4 أي ن م 0 أ ي ي أي ت أي ن م 1 |
إستمارات
خبيث
- سرطان
- خلية صغيرة
- خلية الشوفان
- الخلية الانتقالية
- مختلط
- خلية غير صغيرة
- سرطان الغدة الدرقية
- أسينار
- القصيبات السنخية
- حليمي
- صلب
- غدية حرشفية
- خلية كبيرة
- خلية واضحة
- خلية عملاقة
- الخلايا الحرشفية
- خلية المغزل
- سرطان الغدة القصبية
- الكيسي الغداني
- مخاطي بشروي
- الكارسينويد
- الورم اللمفاوي
- مرض هودجكين الرئوي الأولي
- مرض الرئة غير هودجكين الأولي
حميد
- الحنجرة الرغامية القصبية
- الورم الغدي
- الورم الحليمي
- الورم العضلي الأرومي
- الورم الحليمي
- النسيج الحشوي
- الورم الليفي
- الورم الحليمي
- الورم العضلي الأملس
- الورم الشحمي
- الورم الليفي العصبي/الورم الشفاني
- الورم الدموي المصلب
يتطلب التحول الخبيث للخلايا الظهارية التنفسية تعرضًا طويل الأمد لمواد مسرطنة وتراكمًا لطفرات جينية متعددة. تساهم الطفرات في الجينات التي تحفز نمو الخلايا (K-RAS، MYC)، وتُشفّر مستقبلات عامل النمو (EGFR، HER2/neu)، وتثبط موت الخلايا المبرمج (BCL-2)، في تكاثر الخلايا المرضية. وللطفرات التي تثبط جينات كابتة للأورام (p53، APC) التأثير نفسه. وعندما تتراكم هذه الطفرات بشكل كافٍ، تتطور أورام خبيثة في أعضاء الجهاز التنفسي.
يُقسّم سرطان الرئة عادةً إلى سرطان الرئة صغير الخلايا (SCLC) وسرطان الرئة غير صغير الخلايا (NSCLC). يُعدّ سرطان الرئة صغير الخلايا ورمًا شديد العدوانية، ويصيب المدخنين في أغلب الأحيان، ويُسبب نقائل واسعة النطاق لدى 60% من المرضى عند التشخيص. أما أعراض سرطان الرئة غير صغير الخلايا، فتختلف باختلاف النوع النسيجي.
المضاعفات والنتائج
يبدأ علاج الانصباب الجنبي الخبيث ببزل الصدر. لا تتطلب الانصبابات غير المصحوبة بأعراض علاجًا؛ أما الانصبابات المصحوبة بأعراض والتي تتكرر رغم بزل الصدر المتكرر، فيتم تصريفها عبر أنبوب صدري. يُسبب حقن التلك (أو أحيانًا التتراسيكلين أو البليومايسين) في التجويف الجنبي (إجراء يُسمى تثبيت التجويف الجنبي) تصلبًا جنبيًا، ويزيل التجويف الجنبي، وهو إجراء فعال في أكثر من 90% من الحالات.
يُشبه علاج متلازمة الوريد الأجوف العلوي علاج سرطان الرئة: العلاج الكيميائي، أو العلاج الإشعاعي، أو كليهما. تُستخدم الجلوكوكورتيكويدات بشكل شائع، ولكن فعاليتها غير مثبتة. تُعالج الأورام القمية بالجراحة مع أو بدون العلاج الإشعاعي قبل الجراحة، أو العلاج الإشعاعي مع أو بدون العلاج الكيميائي المساعد. يعتمد علاج متلازمات الأورام النظيرة الورمية على الحالة.
التشخيص سرطان الرئة
الفحص الأول هو تصوير الصدر بالأشعة السينية. يمكن أن يُظهر هذا الفحص بوضوح تشوهات محددة، مثل ارتشاحات مفردة أو متعددة أو عقيدة رئوية معزولة، أو تغيرات أكثر دقة، مثل سماكة غشاء الجنب بين الفصوص، وتوسع المنصف، وتضييق القصبة الهوائية والشعب الهوائية، وانخماص الرئة، وارتشاحات نسيجية غير قابلة للشفاء، وآفات تجويفية، أو رواسب أو انصبابات جنبية غير مبررة. تُعتبر هذه النتائج مشتبهًا بها، ولكنها لا تُشخص سرطان الرئة، وتتطلب تقييمًا إضافيًا باستخدام التصوير المقطعي المحوسب عالي الدقة (HRCT) والتأكيد الخلوي.
يمكن للتصوير المقطعي المحوسب أن يكشف عن العديد من البُنى والتغيرات المميزة التي تُساعد في تأكيد التشخيص. كما يُمكن استخدامه لإجراء خزعة بالإبرة من الآفات التي يُمكن الوصول إليها، وهو مهم أيضًا في تحديد مرحلة المرض.
تعتمد تقنيات التشخيص الخلوية أو النسيجية على توافر الأنسجة وموقع الآفات. يُعد فحص البلغم أوالسائل الجنبي أقل الطرق تدخلاً. في المرضى الذين يعانون من السعال المنتج للبلغم، قد تحتوي عينات البلغم التي يتم الحصول عليها عند الاستيقاظ على تركيزات عالية من الخلايا الخبيثة، ولكن محصول هذه الطريقة أقل من 50٪. يُعد السائل الجنبي مصدرًا مناسبًا آخر للخلايا، ولكن يحدث الانصباب في أقل من ثلث الحالات؛ ومع ذلك، فإن وجود انصباب خبيث يشير إلى مرض في المرحلة IIIB على الأقل وهو علامة تشخيصية سيئة. بشكل عام، يمكن تقليل نتائج الخلايا السلبية الكاذبة عن طريق الحصول على أكبر كمية ممكنة من البلغم أو السائل في وقت مبكر من اليوم ونقل العينات على الفور إلى المختبرات لتقليل تأخير المعالجة الذي يؤدي إلى تحلل الخلايا. الخزعة عن طريق الجلد هي الإجراء الأقل تدخلاً. وهو ذو أهمية أكبر في تشخيص المواقع النقيلية (العقد الليمفاوية فوق الترقوة أو غيرها من العقد الليمفاوية الطرفية، الجنبة، الكبد والغدد الكظرية) مقارنة بآفات الرئة بسبب خطر الإصابة بالاسترواح الصدري بنسبة 20-25٪ وخطر النتائج السلبية الكاذبة التي من غير المرجح أن تغير تكتيكات العلاج المتبعة.
تنظير القصبات هو الإجراء الأكثر استخدامًا للتشخيص. نظريًا، الطريقة المُفضّلة للحصول على الأنسجة هي الأقل تدخلًا. عمليًا، غالبًا ما يُجرى تنظير القصبات بالإضافة إلى الإجراءات الأقل تدخلًا أو بدلًا منها نظرًا لارتفاع نتيجته التشخيصية ولأهمية تنظير القصبات في تحديد مرحلة المرض. يتيح الجمع بين فحص الغسيل، وخزعة الفرشاة، والشفط بإبرة دقيقة للآفات القصبية المرئية والعقد اللمفاوية المجاورة للقصبة الهوائية، وتحت القصبة الهوائية، والمنصفية، والهيلارية، التشخيص في 90-100% من الحالات.
تنظير المنصف هو إجراء ذو مخاطر عالية، ويستخدم عادة قبل الجراحة لتأكيد أو استبعاد وجود ورم في الغدد الليمفاوية المنصفية المتضخمة ذات المظهر غير المؤكد.
يُنصح بإجراء خزعة الرئة المفتوحة عن طريق فتح الصدر أو التنظير بالفيديو عندما تفشل الطرق الأقل تدخلاً في إثبات التشخيص لدى المرضى الذين تشير خصائصهم السريرية وبياناتهم الشعاعية بقوة إلى وجود ورم قابل للاستئصال.
 [ 21 ]، [ 22 ]، [ 23 ]، [ 24 ]، [ 25 ]
[ 21 ]، [ 22 ]، [ 23 ]، [ 24 ]، [ 25 ]
تحديد المرحلة
يُصنف سرطان الرئة صغير الخلايا كمرض في مرحلة محدودة أو متقدمة. المرحلة المحدودة هي الورم الذي يقتصر على نصف صدر واحد (بما في ذلك إصابة العقدة الليمفاوية أحادية الجانب) والذي يمكن علاجه بموقع علاج إشعاعي واحد مقبول، باستثناء وجود انصباب جنبي أو تاموري. أما المرحلة المتقدمة فهي الورم في كل من نصف الصدر ووجود انصباب جنبي أو تاموري خبيث. يعاني حوالي ثلث مرضى سرطان الرئة صغير الخلايا من مرض محدود؛ بينما غالبًا ما يعاني الباقون من نقائل بعيدة واسعة النطاق.
يتضمن تحديد مرحلة سرطان الرئة غير صغير الخلايا تحديد حجم الورم وموقعه والعقد الليمفاوية ووجود أو عدم وجود نقائل بعيدة.
يُعدّ التصوير المقطعي المحوسب الرقيق من الرقبة إلى أعلى البطن (للكشف عن نقائل عنق الرحم، وفوق الترقوة، والكبد، والغدة الكظرية) الفحصَ الأولَ لسرطان الرئة صغير الخلايا وغير صغير الخلايا. ومع ذلك، غالبًا ما يعجز التصوير المقطعي المحوسب عن التمييز بين تضخم الغدد الليمفاوية داخل الصدر ما بعد الالتهاب والخبيثة، أو بين آفات الكبد أو الغدة الكظرية الحميدة والخبيثة (وهي الفروق التي تُحدد مرحلة المرض). لذلك، عادةً ما تُجرى دراسات أخرى إذا كانت نتائج التصوير المقطعي المحوسب في هذه المناطق غير طبيعية.
التصوير المقطعي بالإصدار البوزيتروني (PET) تقنية دقيقة وغير باضعة تُستخدم لتحديد العقد اللمفاوية الخبيثة في المنصف وغيرها من النقائل البعيدة (استهداف استقلابي). يُعدّ التصوير المقطعي بالإصدار البوزيتروني-التصوير المقطعي المحوسب المتكامل، الذي يُدمج فيه التصويران في صورة واحدة بواسطة ماسحات ضوئية مشتركة، أكثر دقة في تحديد مراحل مرض الخلايا غير الصغيرة مقارنةً بالتصوير المقطعي المحوسب أو التصوير المقطعي بالإصدار البوزيتروني وحدهما أو مقارنةً بالربط البصري للدراستين. يقتصر استخدام التصوير المقطعي بالإصدار البوزيتروني والتصوير المقطعي المحوسب-التصوير المقطعي المحوسب على التكلفة والتوافر. في حال عدم توافر التصوير المقطعي بالإصدار البوزيتروني، يُمكن استخدام تنظير القصبات، وفي حالات أقل شيوعًا، تنظير المنصف أو تنظير الصدر بمساعدة الفيديو لإجراء خزعة من العقد اللمفاوية المنصفية المشكوك فيها. في حال عدم استخدام التصوير المقطعي بالإصدار البوزيتروني، يجب تقييم الكتل الكبدية أو الكظرية المشتبه بها عن طريق خزعة بالإبرة.
يعتبر تصوير الصدر بالرنين المغناطيسي أكثر دقة قليلاً من التصوير المقطعي المحوسب عالي الدقة في الجزء العلوي من الصدر لتشخيص الأورام القمية أو الكتل القريبة من الحجاب الحاجز.
يجب على المرضى الذين يعانون من صداع أو اختلالات عصبية الخضوع لتصوير مقطعي محوسب أو تصوير بالرنين المغناطيسي للرأس، وتقييم متلازمة الوريد الأجوف العلوي. يجب على المرضى الذين يعانون من آلام في العظام أو ارتفاع في مستوى الكالسيوم أو الفوسفاتاز القلوي في المصل الخضوع لمسح العظام بالنويدات المشعة. لا يُنصح بإجراء هذه الدراسات في حال عدم وجود أعراض أو علامات أو اختلالات مخبرية مشبوهة. لا تلعب فحوصات الدم الأخرى، مثل تعداد الدم الكامل، وألبومين المصل، والكرياتينين، دورًا في تحديد المرحلة، ولكنها توفر معلومات تشخيصية مهمة حول قدرة المريض على تحمل العلاج.
ما الذي يجب فحصه؟
ما هي الاختبارات المطلوبة؟
من الاتصال؟
علاج او معاملة سرطان الرئة
يتضمن علاج سرطان الرئة عادةً تقييم جدوى الجراحة، تليها الجراحة، والعلاج الكيميائي، و/أو العلاج الإشعاعي، وذلك حسب نوع الورم ومرحلته. قد تؤثر العديد من العوامل غير المرتبطة بالورم على جدوى الجراحة. قد يؤدي ضعف احتياطي القلب والرئة، وسوء التغذية، وسوء الحالة البدنية، والأمراض المصاحبة، بما في ذلك قلة الكريات الدموية، والضعف النفسي أو الإدراكي، إلى اختيار العلاج التلطيفي بدلاً من العلاج المكثف، أو إلى عدم تلقي أي علاج على الإطلاق، حتى مع إمكانية الشفاء منه تقنيًا.
يتم إجراء الجراحة فقط عندما يكون لدى المريض احتياطي رئوي كافٍ بعد استئصال الفص أو الرئة بالكامل. يخضع المرضى الذين لديهم حجم زفير قسري في ثانية واحدة (FEV1) قبل الجراحة أكبر من 2 لتر عادةً لاستئصال الرئة. يجب أن يخضع المرضى الذين لديهم FEV1 أقل من 2 لتر لمسح تروية النويدات المشعة الكمي لتحديد مقدار فقدان الوظيفة الذي يمكن أن يتوقعه المريض نتيجة الاستئصال. يمكن التنبؤ بـ FEV1 بعد الجراحة عن طريق ضرب النسبة المئوية لتروية الرئة غير المستأصلة في FEV1 قبل الجراحة. يشير FEV1 المتوقع> 800 مل أو> 40٪ من FEV1 الطبيعي إلى وظيفة رئة كافية بعد الجراحة، على الرغم من أن دراسات جراحة تقليل حجم الرئة لدى مرضى الانسداد الرئوي المزمن تشير إلى أن المرضى الذين يعانون من FEV1 < 800 مل قد يتحملون الاستئصال إذا كانت الآفة موجودة في مناطق فقاعية ضعيفة الأداء (عادةً ما تكون قمية) من الرئة. يعاني المرضى الذين يخضعون لعملية الاستئصال في المستشفيات ذات معدل العمليات الجراحية المرتفع من مضاعفات أقل ويكونون أكثر عرضة للبقاء على قيد الحياة من المرضى الذين يخضعون للعملية في المستشفيات ذات الخبرة الجراحية الأقل.
طُوّرت أنظمة علاج كيميائي عديدة ، ولم يُثبت أي نظام تفوقه. لذلك، يعتمد اختيار النظام العلاجي غالبًا على الخبرة المحلية، وموانع الاستعمال، وسمية الدواء. ويعتمد اختيار الدواء لعلاج الانتكاس بعد العلاج على موقع الورم، ويشمل تكرار العلاج الكيميائي للانتكاس الموضعي، والعلاج الإشعاعي للنقائل، والعلاج الإشعاعي الموضعي لمرض داخل القصبة الهوائية عندما يتعذر إجراء إشعاع خارجي إضافي.
ينطوي العلاج الإشعاعي على خطر الإصابة بالتهاب رئوي إشعاعي عند تعرض مناطق واسعة من الرئة لجرعات عالية من الإشعاع لفترة طويلة. قد يحدث التهاب رئوي إشعاعي خلال 3 أشهر من تلقي حزمة العلاج. قد يشير السعال، وضيق التنفس، والحمى الخفيفة، أو ألم الجنبة إلى تطور هذه الحالة، بالإضافة إلى الصفير أو احتكاك الجنبة. قد تكون الأشعة السينية للصدر غير محددة؛ وقد يُظهر التصوير المقطعي المحوسب تسللًا غامضًا دون وجود كتلة منفصلة. غالبًا ما يتم التشخيص بالاستبعاد. يُعالج التهاب الرئة الإشعاعي بجرعة 60 ملغ من بريدنيزولون لمدة تتراوح بين أسبوعين و4 أسابيع، ثم تُخفف تدريجيًا.
لأن العديد من المرضى يموتون، فإن رعاية ما قبل الوفاة ضرورية. أعراض ضيق التنفس، والألم، والقلق، والغثيان، وفقدان الشهية هي الأكثر شيوعًا، ويمكن علاجها بالمورفين الوريدي، والمسكنات الأفيونية الفموية، أو الجلدية، أو الوريدية، ومضادات القيء.
علاج سرطان الرئة ذو الخلايا الصغيرة
عادةً ما يكون سرطان الرئة صغير الخلايا، في أي مرحلة، حساسًا للعلاج في البداية، ولكن هذا العلاج قصير الأمد. عادةً لا تلعب الجراحة دورًا في علاج سرطان الرئة صغير الخلايا، مع أنها قد تكون خيارًا متاحًا في حالات نادرة من المرضى الذين يعانون من ورم مركزي صغير غير منتشر (مثل عقيدة رئوية معزولة).
في مرحلة المرض المحدودة، تُعدّ أربع دورات من العلاج المركب باستخدام الإيتوبوسيد وعامل بلاتيني (سيسبلاتين أو كاربوبلاتين) على الأرجح النظام العلاجي الأكثر فعالية، على الرغم من استخدام تركيبات مع عوامل أخرى، بما في ذلك قلويدات فينكا (فينبلاستين، فينكريستين، فينوريلبين)، وعوامل ألكلة (سيكلوفوسفاميد، أيزوفوسفاميد)، ودوكسوروبيسين، وتاكسانات (دوسيتاكسيل، باكليتاكسيل)، وجيمسيتابين، بكثرة. يُحسّن العلاج الإشعاعي الاستجابة بشكل أكبر؛ إذ يستند تعريف المرض المحدود بأنه يقتصر على نصف الصدر إلى فائدة البقاء الكبيرة التي تُلاحظ مع العلاج الإشعاعي. يقترح بعض الخبراء تشعيع الجمجمة للوقاية من نقائل الدماغ؛ فالنقائل الدقيقة شائعة في سرطان الرئة صغير الخلايا، ولا تعبر أدوية العلاج الكيميائي حاجز الدم الدماغي.
في الحالات المتقدمة من المرض، يكون العلاج مماثلاً للعلاج في مرحلة محدودة، ولكن دون استخدام العلاج الإشعاعي المتزامن. قد يُحسّن استبدال الإيتوبوسيد بمثبطات توبويزوميراز (إيرينوتيكان أو توبوتيكان) من فرص البقاء على قيد الحياة. تُستخدم هذه الأدوية، بمفردها أو مع أدوية أخرى، بشكل شائع في علاج الأمراض المقاومة للعلاج وفي الأورام الخبيثة التنفسية المتكررة في أي مرحلة. ويُستخدم الإشعاع غالباً كعلاج مُلطّف لنقائل العظام أو الدماغ.
بشكل عام، يحمل سرطان الرئة ذو الخلايا الصغيرة تشخيصًا سيئًا، على الرغم من أنه ينبغي تقديم المشاركة في التجارب السريرية للمرضى الذين يتمتعون بحالة أداء جيدة.
علاج سرطان الرئة ذو الخلايا غير الصغيرة
يعتمد علاج سرطان الرئة ذو الخلايا غير الصغيرة على المرحلة. في المرحلتين الأولى والثانية، يكون العلاج القياسي هو الاستئصال الجراحي مع استئصال الفص أو استئصال الرئة، مع تشريح انتقائي أو كلي للعقدة الليمفاوية المنصفية. ويُنظر في عمليات الاستئصال الأصغر، بما في ذلك استئصال القطعة واستئصال الإسفين، للمرضى الذين يعانون من ضعف الاحتياطي الرئوي. تُحقق الجراحة نتائج علاجية في حوالي 55-75% من مرضى المرحلة الأولى و35-55% من مرضى المرحلة الثانية. يُحتمل أن يكون العلاج الكيميائي المساعد فعالاً في المراحل المبكرة من المرض (Ib وII). ويُلاحظ تحسن في معدل البقاء على قيد الحياة لمدة 5 سنوات (69% مقابل 54%) والبقاء على قيد الحياة دون تطور المرض (61% مقابل 49%) باستخدام سيسبلاتين مع فينوريلبين. ونظرًا لصغر التحسن، يجب اتخاذ قرار استخدام العلاج الكيميائي المساعد على أساس فردي. ويبقى دور العلاج الكيميائي المساعد قبل المراحل المبكرة في تجارب المرحلة الأولى.
يتميز مرض المرحلة الثالثة بوجود ورم واحد أو أكثر متقدم موضعيًا، مع إصابة عقد ليمفاوية إقليمية دون نقائل بعيدة. بالنسبة لمرض المرحلة الثالثة أ، مع نقائل عقد ليمفاوية منصفية خفية تُكتشف جراحيًا، يوفر الاستئصال معدل بقاء لمدة خمس سنوات يتراوح بين 20% و25%. يُعتبر العلاج الإشعاعي، مع أو بدون العلاج الكيميائي، هو المعيار لمرض المرحلة الثالثة أ غير القابل للاستئصال، ولكن معدل البقاء على قيد الحياة منخفض (متوسط البقاء على قيد الحياة يتراوح بين 10 و14 شهرًا). أظهرت الدراسات الحديثة نتائج أفضل قليلاً مع العلاج الكيميائي قبل الجراحة، بالإضافة إلى العلاج الإشعاعي والعلاج الكيميائي بعد الجراحة. ولا يزال هذا مجالًا لمزيد من البحث.
تتطلب المرحلة IIIB، مع إصابة العقدة الليمفاوية المنصفية أو فوق الترقوة في الجانب المقابل، أو الانصباب الجنبي الخبيث، العلاج الإشعاعي أو العلاج الكيميائي أو كليهما. تُحسّن إضافة عوامل العلاج الكيميائي المُحسِّسة للإشعاع، مثل سيسبلاتين وباكليتاكسيل وفينكريستين وسيكلوفوسفاميد، فرص البقاء على قيد الحياة بشكل طفيف. عادةً ما يُعالَج المرضى الذين يعانون من أورام متقدمة موضعيًا تشمل القلب أو الأوعية الدموية الكبرى أو المنصف أو العمود الفقري بالعلاج الإشعاعي. في حالات نادرة (T4N0M0)، قد يكون الاستئصال الجراحي مع العلاج الكيميائي الإشعاعي المساعد أو المُساعد ممكنًا. يبلغ معدل البقاء على قيد الحياة لمدة خمس سنوات للمرضى الذين عولجوا في المرحلة IIIB 5%.
يهدف علاج سرطان الرئة في المرحلة الرابعة إلى تخفيف الأعراض. يمكن استخدام العلاج الكيميائي والعلاج الإشعاعي لتقليص حجم الورم وعلاج الأعراض وتحسين جودة الحياة. مع ذلك، يبلغ متوسط البقاء على قيد الحياة أقل من 9 أشهر؛ بينما ينجو أقل من 25% من المرضى لمدة عام واحد. تشمل الإجراءات الجراحية التلطيفية بزل الصدر وتثبيت الجنبة لعلاج الانصبابات المتكررة، ووضع قسطرة تصريف الجنبة، وتدمير أنسجة الورم التي تشمل القصبة الهوائية والشعب الهوائية الرئيسية بالتنظير القصبي، ووضع الدعامات لمنع انسداد مجرى الهواء، وفي بعض الحالات، تثبيت العمود الفقري في حالة انضغاط النخاع الشوكي الوشيك.
تستهدف بعض العوامل البيولوجية الجديدة الورم. يمكن استخدام جيفيتينيب، وهو مثبط كيناز التيروزين لمستقبلات عامل نمو البشرة (EGFR)، لدى المرضى الذين لم يستجيبوا للبلاتين والدوسيتاكسيل. تشمل العوامل البيولوجية الأخرى في تجارب المرحلة الأولى مثبطات أخرى لمستقبلات عامل نمو البشرة، وأوليجونوكليوتيدات mRNA المضادة لمستقبلات عامل نمو البشرة (الرنا المرسال)، ومثبطات فارنيسيل ترانسفيراز.
من المهم التمييز بين انتكاسة الورم الأولي الثانوي المستقل، وسرطان الرئة ذي الخلايا غير الصغيرة المتكرر موضعيًا، والنقائل البعيدة. يُجرى علاج الورم الأولي الثانوي المستقل وانتكاسة المرض ذي الخلايا غير الصغيرة وفقًا لنفس المبادئ المُطبقة على الأورام الأولية في المرحلتين الأولى والثالثة. إذا استُخدمت الجراحة في البداية، فإن العلاج الإشعاعي هو الطريقة الرئيسية. إذا ظهر الانتكاس على شكل نقائل بعيدة، يُعالج المرضى كما في المرحلة الرابعة مع التركيز على الإجراءات التلطيفية.
في مجموعة التدابير العلاجية، من المهم جدًا اتباع نظام غذائي لسرطان الرئة.
مزيد من المعلومات عن العلاج
الوقاية
لا يمكن الوقاية من سرطان الرئة إلا بالإقلاع عن التدخين. لم يثبت فعالية أي تدخل فعال. يُزيل خفض مستويات الرادون المرتفعة في المنازل الإشعاع المسبب للسرطان، ولكن لم يُثبت أنه يُقلل من الإصابة بسرطان الرئة. من المُرجّح ألا يكون لزيادة استهلاك الفواكه والخضراوات الغنية بالريتينويدات وبيتا كاروتين أي تأثير على سرطان الرئة. أما مكملات الفيتامينات للمدخنين، فإما أنها غير مُثبتة الفائدة (فيتامين هـ) أو أنها ضارة (بيتا كاروتين). وتحتاج البيانات الأولية التي تُشير إلى أن مضادات الالتهاب غير الستيرويدية ومكملات فيتامين هـ قد تحمي المدخنين السابقين من سرطان الرئة إلى تأكيد. ويجري حاليًا استكشاف مناهج جزيئية جديدة تستهدف مسارات إشارات الخلايا وتنظيم دورة الخلية، بالإضافة إلى المستضدات المرتبطة بالورم.
توقعات
سرطان الرئة مُتوقع شفاء ضعيف، حتى مع أحدث العلاجات. في المتوسط، يعيش المرضى غير المُعالجين، والذين يعانون من مرض الخلايا غير الصغيرة في مراحله المبكرة، حوالي 6 أشهر، بينما يبلغ معدل البقاء على قيد الحياة لمدة 5 سنوات للمرضى المُعالجين حوالي 9 أشهر. أما المرضى المُصابون بمرض الخلايا الصغيرة المُتقدم، فيكون معدل البقاء على قيد الحياة لمدة 5 سنوات أقل من 1%. يبلغ متوسط البقاء على قيد الحياة في الحالات المحدودة من المرض 20 شهرًا، مع معدل شفاء لمدة 5 سنوات يبلغ 20%. يُطيل العلاج الكيميائي حياة العديد من مرضى سرطان الرئة ذي الخلايا الصغيرة ويُحسّن نوعية حياتهم بما يكفي لتبرير استخدامه. يختلف معدل البقاء على قيد الحياة لمدة 5 سنوات لمرضى سرطان الرئة ذي الخلايا غير الصغيرة باختلاف المرحلة، حيث يتراوح بين 60% و70% للمرضى في المرحلة الأولى، ويكاد يكون صفرًا بالنسبة للمرضى في المرحلة الرابعة؛ وتشير البيانات المُتاحة إلى بقاء أفضل للمرضى في المراحل المُبكرة من المرض مع أنظمة العلاج الكيميائي القائمة على البلاتين. ونظرًا لنتائج العلاج المُخيبة للآمال للمرض في مراحله المتأخرة، تُركز جهود خفض الوفيات بشكل متزايد على الكشف المُبكر وتدابير الوقاية الفعالة.
يكشف فحص تصوير الصدر بالأشعة السينية للمرضى المعرضين لخطر كبير عن سرطان الرئة مبكرًا، ولكنه لا يقلل من معدل الوفيات. يُعد فحص التصوير المقطعي المحوسب أكثر دقة في الكشف عن الأورام، إلا أن ارتفاع معدل النتائج الإيجابية الكاذبة يزيد من عدد الإجراءات التشخيصية غير الضرورية والتوغلية المستخدمة لتأكيد نتائج التصوير المقطعي المحوسب. هذه الإجراءات مكلفة وتنطوي على خطر حدوث مضاعفات. تُدرس حاليًا استراتيجية التصوير المقطعي المحوسب السنوي للمدخنين، متبوعًا بالتصوير المقطعي بالإصدار البوزيتروني (PET) أو التصوير المقطعي المحوسب عالي الدقة، لتقييم الآفات غير المحددة. في الوقت الحالي، لا يبدو أن هذه الاستراتيجية تقلل من معدل الوفيات، ولا يمكن التوصية بها للممارسة الروتينية. قد تشمل الدراسات المستقبلية مزيجًا من التحليل الجزيئي للجينات الواسمة (مثل K-RAS، وp53، وEGFR)، وقياس الخلايا البلغمية، والكشف عن المركبات العضوية المرتبطة بالسرطان (مثل الألكان والبنزين) في الزفير.

