خبير طبي في المقال
منشورات جديدة
فقر الدم النخامي (التقزم)
آخر مراجعة: 12.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
مصطلح "قزامة الغدة النخامية" (من الكلمة اليونانية nanos - قزم؛ مرادف: قزامة، nanosomia، microsomia) يعني بالمعنى المطلق مرضًا، مظهره الرئيسي هو تأخر حاد في النمو، مرتبط بانتهاك إفراز هرمون النمو بواسطة الغدة النخامية الأمامية.
بالمعنى الأوسع، التقزم هو اضطراب في النمو والتطور البدني، والذي يمكن أن يحدث ليس فقط بسبب نقص مطلق أو نسبي في هرمون النمو بسبب أمراض الغدة النخامية نفسها، ولكن أيضًا بسبب اضطراب التنظيم الوطائي (الدماغي) لوظائفها، وعيوب في التخليق الحيوي لهرمون النمو، واضطرابات حساسية الأنسجة لهذا الهرمون.
الأسباب القزامة
معظم أشكال تقزم الغدة النخامية هي أمراض وراثية. وأكثرها شيوعًا هو تقزم قصور الغدة النخامية الشامل، والذي يُورث بشكل رئيسي بطريقة متنحية. ويُفترض أن هناك نوعين من انتقال هذا الشكل من الأمراض - وراثي جسدي ومن خلال الكروموسوم X. في هذا الشكل من التقزم، إلى جانب خلل في إفراز هرمون النمو، غالبًا ما يتعطل إفراز هرمون الغدد التناسلية والهرمون المحفز للغدة الدرقية. يتعطل إفراز هرمون قشر الكظر بشكل أقل تواترًا وبدرجة أقل. أظهرت الدراسات الوظيفية باستخدام الهرمونات المطلقة، بما في ذلك هرمون إطلاق هرمون النمو الاصطناعي (المكون من 29 و40 و44 بقايا حمض أميني)، على غرار بولي ببتيد البنكرياس، أن معظم هؤلاء المرضى يعانون من أمراض على مستوى منطقة ما تحت المهاد، وأن قصور الغدة النخامية الأمامية ثانوي. أما الأمراض الأولية للغدة النخامية نفسها فهي أقل شيوعًا.
يُلاحظ التقزم الوراثي المصحوب بنقص هرمون النمو المعزول، مع ضعف النشاط البيولوجي والحساسية تجاهه، بشكل متقطع في روسيا والدول المجاورة. وهو أكثر شيوعًا في القارة الأمريكية، ودول الشرقين الأدنى والأوسط، وأفريقيا. بناءً على نتائج دراسة محتوى هرمون النمو في الدم وحساسية المرضى لهرمون النمو الخارجي، ومستوى الأنسولين المتفاعل مناعيًا (IRI)، وعوامل النمو الشبيهة بالأنسولين (IGF) من النوع الأول (سوماتوميدين سي) والنوع الثاني، واستجابة عامل النمو الشبيه بالأنسولين-1 للعلاج بمستحضرات هرمون النمو، تم تحديد أنواع مختلفة من التقزم المتشابهة سريريًا.
في الآونة الأخيرة، تم فك شفرة مسببات مرض التقزم لارون، والذي يحدث بسبب نقص IRF-1 وIRF-II، وكذلك مسببات مرض التقزم في الأقزام الأفارقة، المرتبط بنقص الأول.
في عام 1984، تم وصف نوع جديد من التقزم الكاذب النخامي مع مستوى مرتفع من هرمون النمو وIGF-1؛ يتم تفسير نشأة التقزم من خلال خلل في مستقبلاته، والذي تم إثباته من خلال الانخفاض الحاد في ارتباط الخلايا الليفية الجلدية بـIGF-1.
ومن الجدير بالذكر أنه في الظروف الحديثة، ومع وجود عائلات صغيرة، فإن العديد من الحالات المعزولة ("مجهولة السبب"، المتفرقة) من المرض يمكن أن تكون وراثية أيضًا.
في تحليل 350 حالة مرضية، كان سبب التقزم غير واضح لدى 228 مريضًا (65.2%). شملت هذه المجموعة مرضى من 57 عائلة تعاني من تكرار الإصابة بالتقزم (2-4 حالات لكل عائلة)، وهو ما يمثل 28% من إجمالي المرضى. في 77% من العائلات التي تعاني من أشكال التقزم غير الواضحة من حيث السبب (وراثية في الغالب)، ثبت وجود علاقة لا يمكن إنكارها مع وراثة غياب عامل الريزوس. يختلف توزيع عامل الريزوس في عائلات مرضى التقزم عن ذلك الملحوظ في حالة تعارض عامل الريزوس بين الأم والجنين، وكقاعدة عامة، لا يصاحبه مرض انحلال الدم لدى المولود الجديد (قد يكون الأب سلبي عامل الريزوس، وفي حالة تغاير الزيجوت لدى الوالدين لعامل الريزوس - الأبناء، إلخ). من الممكن افتراض وجود صلة بين نشاط الجينات المسؤولة عن تخليق هرمون السوماتوتروبين (أو هرمون تحرير السوماتوتروبين) والجينات التي تحدد عامل الريزوس، خاصةً وأن معظم أشكال التقزم وغياب عامل الريزوس هي صفات جسمية متنحية. هذا لا يفسر الندرة النسبية للقزامة مقارنةً بتكرار الأفراد ذوي عامل الريزوس السلبي في المجتمع. من المرجح أن بعض العوامل الإضافية غير المعروفة حتى الآن مهمة، ولكن من غير المرجح أن تكون سمات توزيع عامل الريزوس في عائلات المرضى المصابين بالتقزم العائلي والمتقطع عرضية.
مجموعة كبيرة من المرضى الذين يعانون من التقزم (الدماغي الأولي، الدماغي النخامي) هم مرضى يعانون من أنواع مختلفة من الأمراض العضوية في الجهاز العصبي المركزي التي نشأت في الرحم أو في مرحلة الطفولة المبكرة. قد يكون الركيزة التشريحية التي تسبب هذا المرض هو نقص نمو الغدة النخامية أو غيابها، أو ديستوبيا في علم أمراض تكوين السرج التركي، أو التنكس الكيسي للغدة النخامية، أو ضمورها بسبب الضغط بواسطة ورم (ورم قحفي بلعومي، ورم غدي كروموفوبي ، ورم سحائي، ورم دبقي). قد يحدث التقزم بسبب الإصابات الرضحية في منطقة تحت المهاد النخامية (داخل الرحم، أو الولادة، أو بعد الولادة)، والتي تحدث غالبًا في حالات الحمل المتعددة، وكذلك أثناء الولادة في وضع المقعد، أو وضع القدم، أو في الوضع المستعرض مع الدوران على الساق (هذه هي آلية الولادة في أكثر من ثلث المرضى الذين يعانون من التقزم). تُعد الأضرار المعدية والسامة بالغة الأهمية (مثل العدوى الفيروسية داخل الرحم، والسل ، والزهري، والملاريا، وداء المقوسات؛ والأمراض في سن مبكرة، وتسمم الدم لدى حديثي الولادة، والتهاب السحايا والتهاب الدماغ العنكبوتي، وغيرها). يمكن لهذه العمليات أن تُلحق الضرر بالغدة النخامية نفسها، ومراكز الوطاء التي تُنظم وظائفها، وتُعطل الروابط الوظيفية الطبيعية في الجهاز العصبي المركزي.
يمكن أن تؤدي الآفات الجنينية داخل الرحم إلى ولادة مرضى يعانون من "التقزم منذ الولادة" مع إفراز طبيعي لهرمون النمو (التقزم البدائي الدماغي، صغر الرأس، التقزم الفضي راسل مع عدم تناسق نصف الجسم ومستويات عالية من الغدد التناسلية، إلخ).
قد تكون العوامل الإضافية التي تؤدي إلى تفاقم انتهاك التطور البدني في التقزم هي سوء التغذية، وعدم التوازن من حيث المكونات الأساسية (نقص البروتين) والعناصر الدقيقة (نقص الزنك)، والظروف البيئية غير المواتية، فضلاً عن الأمراض المزمنة المختلفة، مثل التهاب كبيبات الكلى، حيث تؤثر الآزوتيمية على نشاط مستقبلات الكبد أو تؤثر بشكل مباشر على عملية التمثيل الغذائي لخلايا الكبد، مما يتسبب في انخفاض في تخليق السوماتوميدين، أو تليف الكبد، عندما يضعف تكوين السوماتوميدين.
طريقة تطور المرض
في معظم المرضى الذين يعانون من تقزم الغدة النخامية، لا تقتصر التغييرات على أمراض إفراز هرمون النمو والحساسية له، بل تمتد إلى هرمونات استوائية أخرى في الغدة النخامية، مما يسبب مجموعات مختلفة من الاضطرابات الغدد الصماء والأيضية.
في حالات نقص هرمون النمو المنعزل، لم تُدرس التغيرات المورفولوجية في الغدة النخامية بشكل كافٍ. في الحالات المدروسة، نادرًا ما وُجدت اضطرابات مرضية (مثل ورم قحفي بلعومي أو فرط تنسج عظام الجمجمة). في هذا النوع من التقزم، قد يُلاحظ تخلف خلقي في نمو الخلايا الببتيدية أو خلل في نظام الناقل العصبي في منطقة ما تحت المهاد. في مثل هذه الحالات، قد يترافق التقزم مع خلل تنسج أو نقص تنسج العصب البصري. تؤدي الأكياس داخل السرج، وأورام الغدة النخامية وتحت المهاد، إلى نقص هرمون النمو، مما يُسبب ضغطًا على أنسجة الغدة النخامية، وخاصةً الخلايا الجسدية.
يتميز التقزم بترقق العظام، ويعود ذلك أساسًا إلى تأخر نمو الطبقة القشرية، وتأخر التمايز، وتكوين العظام في الهيكل العظمي. وتكون الأعضاء الداخلية ناقصة التنسج، وأحيانًا ضامرة، وضعف نمو العضلات.
الأعراض القزامة
يُعدّ التأخر الحاد في النمو والتطور البدني من أبرز مظاهر قزامة الغدة النخامية. يولد المرضى بوزن وطول طبيعيين، ويبدأ تأخر نموهم من عمر سنتين إلى أربع سنوات.
قبل ظهور العلاج الفعال للقزامة، كان يُنظر إلى الأقزام على أنهم من يقل طولهم عن 120 سم للنساء و130 سم للرجال. أما حاليًا، فيختلف طول القزم بمقدار 2-3 انحرافات سيجما على الأقل عن متوسط المعدل الجدولي لجنس أو عمر أو فئة سكانية معينة. كما توجد طريقة لتقييم الطول بيانيًا تعتمد على منحنى التوزيع الغاوسي. في هذه الحالة، يُدرج الأقزام حسب الطول في مجموعة تضم أقل عدد من الأفراد في الفئة السكانية المقابلة ذات التأخر الأكبر عن متوسط معدل النمو.
لا يتميز تقزم الغدة النخامية بصغر حجم الجسم المطلق فحسب، بل أيضًا بضعف ديناميكيات النمو السنوي والتطور البدني. بنية الجسم متناسبة، لكن نسب أجسام المرضى نموذجية لمرحلة الطفولة. يكون الجلد شاحبًا، وغالبًا ما يكون مائلًا للاصفرار، وجافًا، ويعود ذلك إلى قصور الغدة الدرقية المطلق أو النسبي، وأحيانًا يُلاحظ زرقة الجلد - "تقشّر". في المرضى غير المعالجين، يظهر الجلد متجعدًا وشيخوخة مبكرة. ويعود ذلك إلى قصور التأثير الابتنائي لهرمون الغدة النخامية وبطء تغير الأجيال الخلوية.
قد يكون شعر الرأس طبيعيًا أو جافًا، خفيفًا ومتقصفًا؛ أما الرموش الطويلة فهي طبيعية. غالبًا ما يغيب نمو الشعر الثانوي. لا يتغير حجم السرج التركي لدى معظم مرضى التقزم (70-75%)، ولكنه غالبًا ما يحتفظ بشكله الطفولي البيضاوي، وله ظهر عريض "شبابي"، وجيب العظم الوتدي متأخر في عملية التهوية. ومع ذلك، هناك مرضى يعانون من تضخم السرج التركي، وهو علامة على وجود ورم؛ مع وجود مناطق تكلس على خلفيته أو في منطقة المدخل (مع ورم قحفي بلعومي، أو آثار متبقية من عدوى عصبية) أو انخفاضه (علامات تأخر النمو، وصغر حجم الغدة النخامية). تُلاحظ أعراض ارتفاع ضغط الدم داخل الجمجمة، بما في ذلك: ترقق عظام قبو الجمجمة، وزيادة النمط الوعائي، ووجود بصمات الأصابع، وغيرها. وأهم علامة على قزامة الغدة النخامية هي تأخر توقيت التمايز وتعظم الهيكل العظمي. كما ترتبط سمات الجهاز السني ارتباطًا وثيقًا بتمايز الهيكل العظمي، حيث يُلاحظ تأخر في استبدال الأسنان اللبنية. ويُلاحظ أكبر تأخر في نمو الجهاز الهيكلي لدى مرضى القزامة المصحوبين بقصور في القدرة الجنسية وقصور في الغدة الدرقية.
الأعضاء التناسلية لدى معظم المرضى ناقصة النمو بشكل حاد، مع أن التشوهات نادرة. لاحظنا خصية معلقة لدى 5.8% من المرضى الذكور. يصاحب القصور الجنسي نقص في نمو الخصائص الجنسية الثانوية وانخفاض الرغبة الجنسية وغياب الدورة الشهرية. يُلاحظ النمو الجنسي التلقائي الطبيعي فقط لدى المرضى الذين يعانون من نقص هرمون النمو المعزول، وبعض المرضى المصابين بالتقزم الدماغي.
يُعد قصور الغدة الدرقية عرضًا شائعًا نسبيًا للقزامة. تجدر الإشارة إلى أن المظاهر الخارجية لقصور الغدة الدرقية لا تعكس دائمًا الحالة الوظيفية الحقيقية للغدة الدرقية. ويعود ذلك إلى قصور الغدة الدرقية النسبي الناجم عن خلل في انتقال الثيروكسين (T4 ) إلى ثلاثي يودوثيرونين (T3 ) وتكوين هرمون T3 غير النشط (القابل للعكس) ، وهو سمة مميزة لقصور الغدة الدرقية.
تنخفض وظيفة قشر الكظر في التقزم النخامي بشكل أقل وبدرجة أقل من وظائف تحفيز الجنس والغدة الدرقية، وفي معظم المرضى لا تتطلب تصحيحًا خاصًا.
في معظم الحالات، لا يُصاب المريض بضعف عقلي. وتُلاحظ تغيرات عاطفية تُشبه الطفولة العقلية؛ وفي المرضى الأكبر سنًا غير المصابين بضعف عقلي، قد يُلاحظ أحيانًا عصاب تفاعلي.
في الأمراض الدماغية العضوية، وخاصة تلك المرتبطة بالورم، يمكن أن يحدث التقزم مع أعراض مرض السكري الكاذب، والعمى النصفي الصدغي والإعاقات الفكرية.
أظهرت دراسة تطور النشاط الكهربائي الحيوي للدماغ لدى مرضى لا يعانون من أعراض عضوية في الجهاز العصبي المركزي أن تخطيط كهربية الدماغ لديهم يتميز بخصائص عدم النضج، والحفاظ على جهد كهربية دماغي "طفولي" مرتفع لفترة طويلة؛ وعدم انتظام إيقاع ألفا في السعة والتردد؛ وزيادة حادة في محتوى إيقاعات θ وδ البطيئة، وخاصة في القطبين الأمامي والمركزي؛ ورد فعل واضح لفرط التنفس؛ وتحول في نطاق إيقاعات تخطيط كهربية الدماغ، متبعًا إيقاعات التحفيز الضوئي، نحو الترددات المنخفضة (دليل على انخفاض في الحركة الوظيفية للهياكل العصبية في الدماغ). وقد تبين أن عدم نضج النشاط الكهربائي للدماغ لدى المرضى الأكبر سنًا يعود إلى التخلف الجنسي، بينما يعود قصور الغدة الدرقية لدى المرضى من جميع الفئات العمرية.
يتميز استقلاب الكربوهيدرات لدى مرضى التقزم بميلٍ إلى انخفاض مستوى سكر الدم الصائم، وارتفاعه أثناء المجهود البدني، وقصورٍ في الأنسولين الداخلي، وزيادةٍ في الحساسية للأنسولين الخارجي، مع تواتر ظهور حالات نقص سكر الدم. ويُعزى هذا الأخير بشكلٍ رئيسي إلى نقص مستويات الهرمونات المضادة للانقسام في أجسام المرضى.
تظهر الأعضاء الداخلية تضخمًا في الأنسجة الحشوية، أي تناقصًا في حجمها. لم تُوصف أي تغيرات وظيفية في الأعضاء الداخلية خاصة بالتقزم. غالبًا ما يُلاحظ انخفاض ضغط الدم الشرياني مع انخفاض الضغط الانقباضي والانبساطي وانخفاض سعة النبض. تكون أصوات القلب مكتومة، وتُسمع نفخات وظيفية من أنواع مختلفة بسبب التغيرات الغذائية في عضلة القلب والاضطرابات اللاإرادية. يتميز تخطيط كهربية القلب بانخفاض الجهد (خاصةً في حالة قصور الغدة الدرقية)، وبطء القلب الجيبي أو اضطراب النظم البطيء؛ بينما يُظهر تخطيط كهربية القلب انخفاضًا في سعة النغمات، ونغمات إضافية، ونفخات وظيفية. تشير بيانات قياس الأكسجين إلى نقص تأكسج الدم (في البداية وأثناء المجهود البدني)، ونقص الأكسجين. يُصاب المرضى المسنون أحيانًا بارتفاع ضغط الدم.
التشخيص القزامة
يعتمد تشخيص التقزم والتفريق بينه وبين غيره على بيانات التاريخ المرضي والفحص السريري والإشعاعي والمخبري والهرموني الشامل. بالإضافة إلى قياس حجم الجسم، ولتقييم نمو المرضى، يُحدد عجز النمو - الفرق بين طول المريض ومتوسط طوله الطبيعي للجنس والعمر المقابلين؛ وعمر النمو - توافق طول المريض مع معايير معينة؛ ومؤشر الانحراف المعياري.
I = M - Mcp / δ، حيث M هو طول المريض، Mcp هو متوسط الطول الطبيعي لجنس وعمر معينين، δ هو الانحراف التربيعي عن Mcp؛ I أقل من 3 هو سمة مميزة للقزامة، I أكبر من 3 هو سمة مميزة للعملقة. يمكن استخدام هذا المؤشر لتقييم ديناميكيات النمو.
يكشف الفحص بالأشعة السينية لمرضى التقزم عن علامات ارتفاع ضغط الدم داخل الجمجمة، والآثار المتبقية من عدوى عصبية، والتكلسات، وانغلاق الدروز الباكر. تُعتبر دراسة حجم وشكل وبنية السرج التركي مؤشرًا غير مباشر يُميز حجم الغدة النخامية. يُعدّ انتهاك تمايز الهيكل العظمي من أهم مظاهر تأخر النمو المرضي. لتقييم درجة نضج الهيكل العظمي، يُحدد عمر العظام (الشعاعي)، والذي يتوافق مع تمايز أنسجة العظام؛ ويُعرّف نقص التعظم بأنه درجة تأخر التعظم عن المعدل الطبيعي (بالسنوات)، ويُعرّف مُعامل التعظم بأنه حاصل قسمة عمر العظام على العوامل الزمنية وغيرها.
يستحيل تشخيص التقزم الحديث دون دراسة إفراز هرمون النمو، ومستواه الأساسي، وإيقاعه اليومي، وإفرازه تحت التحفيز. يتميز معظم مرضى التقزم النخامي بانخفاض محتوى هرمون النمو في مصل الدم. وعند تحديده بطريقة المناعة الإشعاعية، يتراوح (وفقًا لمؤلفين مختلفين) بين (0.87±0.09) و(1.50±0.64) نانوغرام/مل، بمتوسط معياري يبلغ (3.81±0.29) نانوغرام/مل. أظهرت دراسة الإيقاعات اليومية (اليومية) لإفراز هرمون النمو أن مستواه لدى الأشخاص الأصحاء يبلغ ذروته خلال أول ساعتين من النوم وبين الساعة 4-6 صباحًا. وفي التقزم، ينخفض محتوى هرمون النمو خلال هذه الساعات أيضًا.
لدراسة احتياطيات وظيفة هرمون النمو، تُستخدم منشطات مختلفة، مع فحص محتوى هرمون النمو قبل وبعد إدخاله. يُسحب الدم للدراسة كل 30 دقيقة لمدة ساعتين إلى ثلاث ساعات. يُعتبر إفراز هرمون النمو بعد التحفيز طبيعيًا، بحد أدنى 7-10 نانوغرام/مل، وقد يصل أحيانًا إلى 20-40 نانوغرام/مل. في حال عدم وجود أي تفاعل في إحدى العينات، تُجرى اختبارات متكررة باستخدام منشطات أخرى. يُعتبر قصور هرمون النمو مُثبتًا في حال عدم إفرازه في 2-3 عينات مختلفة.
الاختبارات المحفزة الأكثر شيوعًا هي: إعطاء 0.1 وحدة (0.75-1.5 وحدة) من الأنسولين عن طريق الوريد لكل كيلوغرام واحد من وزن المريض، وعند حدوث نقص سكر الدم (انخفاض في مستوى الجلوكوز في الدم بنسبة 50% مقارنةً بالمستوى الأولي)، يُحدد مستوى هرمون النمو في المصل وفقًا للمخطط المذكور أعلاه. في حال حدوث نقص سكر الدم الشديد، يُوقف الاختبار ويُعطى المريض الجلوكوز عن طريق الوريد. تُعد هذه الطريقة التشخيصية الكلاسيكية الأكثر شيوعًا.
يُعطى هرمون TRH بجرعة 200-500 ميكروغرام عن طريق الوريد. يُحدد هذا الهرمون احتياطيات الهرمونات بفعالية، ولا يُسبب أي مضاعفات. وبالتزامن مع اختبار الأنسولين، يُمكّن من تقييم مستوى تلف الجهاز تحت المهاد-النخامي. يشير رد الفعل الإيجابي تجاه هرمون TRH، في حال عدم وجود نقص سكر الدم الناتج عن الأنسولين، إلى سلامة الغدة النخامية ووجود تلف في منطقة تحت المهاد، بينما يُشير رد الفعل السلبي تجاه هرمون TRH ونقص سكر الدم إلى تلف الغدة النخامية نفسها.
إن إعطاء TRH و LH-RH بجرعة 300 ميكروجرام عن طريق الوريد يشبه الجرعة السابقة.
هرمون النمو البشري (SGH) هو نظير اصطناعي لمركب نشط بيولوجيًا معزول من ورم بنكرياسي. يوجد حاليًا ثلاثة أنواع من هرمون النمو الاصطناعي: يحتوي على 29 و40 و44 بقايا من الأحماض الأمينية. يُستخدم عن طريق الوريد بجرعات تتراوح من 1 إلى 3 ميكروغرام/كغ من وزن جسم المريض. يُلاحظ إطلاق هرمون النمو بعد 15-20 دقيقة من الإعطاء، وهو أكثر فعالية من غيره في الكشف عن احتياطيات هرمون النمو الداخلي. يشير رد فعل هرمون النمو الإيجابي إلى مستوى الوطاء من تلف الوظيفة الجسدية والغدة النخامية السليمة؛ مع الأحماض الأمينية (L-أرجينين أحادي الكلوريد، أورنيثين، تريبتوفان، جلايسين، ليوسين) عن طريق الوريد بجرعة 0.25-0.5 غرام لكل 1 كغ من وزن جسم المريض. فعال لدراسة احتياطيات هرمون النمو. قد يسبب ردود فعل تحسسية.
ليفودوبا فمويًا بجرعة ٢٥٠-٥٠٠ ميكروغرام. فعال، ويتحمله المرضى جيدًا.
كما يتم استخدام الاختبارات باستخدام الجلوكاجون، وإرغوكريبتين البروم (بارلوديل)، وفاسوبريسين اللايسين، والكلونيدين، وحمل الدراجة المقنن.
إن دراسة حالة وظيفة الهرمون الموجه للنمو ضرورية ليس فقط لتشخيص التقزم، ولكن أيضًا للاختيار المبرر لطريقة العلاج، حيث أن العلاج بالهرمون الموجه للنمو يكون عقلانيًا فقط في حالة عدم كفاية هرمون النمو الداخلي.
لتشخيص شكل التقزم، من الضروري دراسة محتوى عوامل النمو الشبيهة بالأنسولين، أو السوماتوميدينات (وخاصةً عامل النمو الشبيه بالأنسولين-1، أو سوماتوميدين سي) - وهي وسطاء لتأثير هرمون النمو على مستوى الأنسجة. من المعروف أن محتوى سوماتوميدين سي في التقزم يكون منخفضًا، وفي ضخامة الأطراف يكون مرتفعًا مقارنةً بالمستوى الطبيعي. شكل التقزم الذي وصفه لارون هو نوع من الأمراض يتميز بإنتاج طبيعي لهرمون النمو الشبيه بالأنسولين، ولكنه يصاحبه اضطراب في تكوين عامل النمو الشبيه بالأنسولين-1 وعامل النمو الشبيه بالأنسولين-2. علاج هؤلاء المرضى بالسوماتوتروبين غير مُجدٍ.
المؤشرات غير المباشرة لوظيفة الغدة النخامية الجسدية هي نشاط الفوسفاتاز القلوي ومحتوى الفوسفور غير العضوي في المصل. في ظروف نقص هرمون النمو الجسدي، تنخفض هذه المؤشرات. في شكل قصور الغدة النخامية الشامل من التقزم، ينخفض إفراز الجونادوتروبينات، غالبًا TSH، والذي يصاحبه انخفاض مماثل في وظائف الغدد الجنسية (نقص الأندروجينات أو الإستروجينات)، والغدة الدرقية (انخفاض في مستويات T3 و T4 واليود المرتبط بالبروتين - PBI، وتراكم 131I بواسطة الغدة الدرقية)، والغدد الكظرية (انخفاض في كمية الكورتيزول و17-OCS في البلازما، وإفراز 17-KC و17-OCS في البول، وزيادة الخلايا الليمفاوية).
تتميز جميع أنواع التقزم الوراثي النخامي (تحت المهاد-النخامي) بتكرار إصابة الأطفال في عائلة وراثية بنوع جسمي متنحي (في أغلب الأحيان) أو جسمي سائد، وتأخر في النمو والتطور البدني من سنتين إلى أربع سنوات، مع تأخر لا يقل عن 2-3 درجات عن متوسط النمو الطبيعي لجنس أو عمر أو فئة سكانية معينة، مع انخفاض ديناميكيات النمو السنوي التلقائي، وتأخر في التعظم. مع انخفاض مستوى هرمون النمو (في 2-3 اختبارات تحفيزية أقل من 7 نانوغرام/مل)، يكون العلاج بهرمون النمو فعالاً للغاية (يعطي زيادة في الطول لا تقل عن 7 سم سنويًا). مع مستوى طبيعي أو مرتفع من هرمون النمو (مع خموله البيولوجي)، يمكن الحفاظ على حساسية الجسم للهرمون. لم تُلاحظ أي تغيرات في الذكاء.
في التقزم الوراثي المصحوب بعدم حساسية الأنسجة لهرمون النمو، تتشابه الصورة السريرية مع نقص هرمون النمو المعزول، إلا أن العلاج بهرمون النمو غير فعال. في هذه المجموعة، يمكن التمييز بين الأشكال الرئيسية التالية وفقًا لمستوى IRF: مع محتوى طبيعي (عيب في مستقبلات IRF) وقزامة من نوع لارون منخفضة (نقص IRF-1 وIRF-II)، والنوع الموجود لدى الأقزام الأفارقة (نقص IRF-1).
يتميز التقزم الدماغي بأمراض معزولة في العائلة مرتبطة بضرر داخل الرحم أو بعد الولادة في الجهاز العصبي المركزي، مع وجود تغيرات عضوية واضحة في الجهاز العصبي المركزي، وغالبًا ما تكون مصحوبة بأمراض الجهاز البصري، ووجود مرض السكري الكاذب، والحفاظ على وظائف الغدد التناسلية، والتغيرات في الذكاء.
بعض أنواع خلل تنسج الغدد التناسلية وعدم تكوّنها تصاحبها قصر قامة ملحوظ، وخاصةً متلازمة شيرشيفسكي-تيرنر ومتلازمة خلل تنسج الخصية "التورنرويدي" (الفسيفساء). تساعد الدراسات الخلوية الوراثية (الكروماتين الجنسي، النمط النووي) في التشخيص التفريقي، وكشف العيوب الكروموسومية، بالإضافة إلى العيوب المميزة للنمو الجسدي والجنسي، ومستويات طبيعية أو مرتفعة من هرمون النمو الداخلي، وعدم الحساسية للعلاج بهرمون النمو.
من بين اضطرابات الغدد الصماء التي تحدث مع قصر القامة، يُشار إلى قصور الغدة الدرقية الأولي ، الناتج عن نقص تنسج أو عدم تنسج خلقي في الغدة الدرقية، أو خلل في وظائفها، أو خلل إنزيمي في التخليق الحيوي لهرمونات الغدة الدرقية، أو تلف مناعي ذاتي مبكر في الغدة الدرقية. في جميع هذه الحالات، تسود علامات قصور الغدة الدرقية مع ارتفاع مستوى هرمون TSH، وانخفاض مستويات هرموني T4 وT3 في مصل الدم. في حالة الوذمة المخاطية الناتجة عن نشوء مناعة ذاتية، تُكتشف في الدم أجسام مضادة للثيروجلوبولين، والكسور الميكروسومية والنووية لأنسجة الغدة الدرقية، ويكون مستوى هرمون النمو طبيعيًا أو منخفضًا. يمكن تحقيق التأثير السريري بتعويض قصور الغدة الدرقية فقط.
يصاحب قصر القامة التطور الجنسي المبكر ومتلازمة الغدة الكظرية التناسلية بسبب الإغلاق المبكر لمناطق النمو ؛ مرض Itsenko-Cushing ، الذي يحدث في مرحلة الطفولة بسبب التأثير المثبط للجلوكوكورتيكويدات على إفراز هرمون النمو وتأثيره الهدمي ؛ متلازمة مورياك - قصر القامة والطفولة لدى المرضى الذين يعانون من مرض السكري المعتمد على الأنسولين الشديد.
يجب التمييز بين التقزم النخامي والتأخر الجسدي في النمو البدني الناجم عن الاضطرابات الأيضية المزمنة (في أمراض الكبد والكلى والجهاز الهضمي)، ونقص الأكسجين المزمن (في أمراض الجهاز القلبي الوعائي والجهاز التنفسي، وفي فقر الدم)؛ مع الأمراض الجهازية في الجهاز العضلي الهيكلي (ضمور الغضروف، وتكوين العظم غير الكامل، ومرض النخر العظمي)، وما إلى ذلك.
يُلاحظ أحيانًا تأخر النمو الوظيفي (البنيوي) مع تأخر البلوغ لدى المراهقين الأصحاء ظاهريًا؛ وقد وجدنا أن هذا التأخر يرتبط أساسًا بقصور مؤقت في نشاط الغدد التناسلية. لا يتأثر إفراز هرمون النمو عادةً، أو ينخفض بشكل طفيف. ويمكن لتحفيز الغدد التناسلية أن يُسرّع كلاً من النمو الجنسي والنمو.
ينبغي النظر إلى قصر القامة ذي الطبيعة العائلية باعتباره أحد أشكال التطور الفسيولوجي.
ما الذي يجب فحصه؟
كيف تفحص؟
ما هي الاختبارات المطلوبة؟
من الاتصال؟
علاج او معاملة القزامة
علاج التقزم عملية طويلة، مما يُجبر الطبيب على توزيع وسائل التأثير على النمو على مدار الوقت لتحقيق أقصى تأثير سريري، مع مراعاة مبدأين أساسيين:
- الحد الأقصى لتقريب التطور الناجم عن العلاج إلى الظروف الفسيولوجية؛
- الحفاظ على مناطق النمو المشاشية.
بفضل سنوات الخبرة الطويلة في علاج التقزم، نعتبر أن خطة العلاج التدريجي التالية مناسبة. عادةً ما لا يثير تشخيص التقزم لدى البالغين أي شك. أما بالنسبة للأطفال الصغار، فإذا كانت الصورة السريرية غير واضحة، يلزم تحديد فترة تشخيص تتراوح بين 6 و12 شهرًا تحت المراقبة دون علاج هرموني. خلال هذه الفترة، يُوصف علاج عام مُعقد لتقوية الجسم؛ مع اتباع نظام غذائي صحي مع زيادة البروتين الحيواني والخضراوات والفواكه، وفيتاميني أ ود، ومكملات الكالسيوم والفوسفور. ويُعد عدم وجود تغيرات كافية في النمو والتطور البدني في هذه الحالة، واكتشاف اضطرابات الغدد الصماء أثناء الفحص، أساسًا لبدء العلاج الهرموني.
النوع الرئيسي من العلاج الممرض لقزامة الغدة النخامية هو استخدام هرمون النمو البشري ، حيث أن حدوث معظم حالات التقزم يعتمد بلا شك على شكل أو آخر من أشكال نقصه. ونظرًا لخصوصية هذا الهرمون حسب النوع، فإن هرمون النمو البشري والرئيسي فقط هو النشط للبشر. ويُستخدم على نطاق واسع في العيادة دواء معزول من الغدة النخامية للأشخاص الذين ماتوا بسبب أمراض غير معدية وغير ورمية. ويُحصل على هرمون النمو البشري عن طريق التخليق البكتيري باستخدام بكتيريا الإشريكية القولونية عن طريق الهندسة الوراثية. كما يُصنع هرمون النمو البشري كيميائيًا، ولكنه مكلف للغاية ولا يُستخدم عمليًا في العيادة. ويُختار المرضى الذين يعانون من نقص مؤكد في هرمون النمو الداخلي، مع تمايز هيكلي لا يتجاوز المستوى النموذجي لعمر 13-14 عامًا، لعلاج هرمون النمو. ولا توجد قيود عمرية للعلاج.
الحد الأدنى للجرعات الفعالة التي يمكن استخدامها في الفترة الأولى من العلاج هو 0.03-0.06 ملغ/كغ من وزن الجسم. الجرعات الأكثر فعالية هي 2-4 ملغ 3 مرات أسبوعيًا. لم تُصاحب زيادة الجرعة الواحدة إلى 10 ملغ زيادة كافية في تأثير النمو، بل تسببت في تكوين سريع للأجسام المضادة للهرمون.
في بلدنا، تُجرى دراسة هرمون النمو البشري منذ عام ١٩٦٠. وقد اختُبر نظامان علاجيان: مستمر ومتقطع، بفترات علاجية تتراوح بين شهرين وثلاثة أشهر، وبنفس الفترات الزمنية. بلغ متوسط زيادة طول المرضى خلال السنة الأولى من العلاج ٩.٥٢ ± ٠.٣٩ سم، وبلغ متوسط زيادة وزن الجسم ٤.٤ ± ٠.١٤ كجم. مع العلاج المستمر طويل الأمد، بلغ متوسط زيادة الطول ٠.٨٢ سم/شهر، وبلغ متوسط زيادة وزن الجسم ٠.٣٨ كجم/شهر؛ ومع العلاج المتقطع، بلغ متوسط الزيادة ٠.٧٥ سم/شهر و٠.٤ كجم/شهر، على التوالي. وقد وفّر العلاج المستمر زيادة أسرع في الطول، مع انخفاض حاد في التأثير بعد سنة إلى سنة ونصف، بينما استمرّ العلاج المتقطع لمدة ٣-٤ سنوات، مما يسمح لنا باعتبار نظام العلاج المُختار أكثر ملاءمة. يُمكن أن يُمثل تحديد مستوى عامل النمو الشبيه بالأنسولين IGF-I (سوماتوميدين سي) مؤشرًا موثوقًا لحساسية المريض للعلاج بأدوية السوماتوتروبين. وتُتيح زيادة مستوى عامل النمو الشبيه بالأنسولين IGF-I بعد إعطاء هرمون السوماتوتروبين التنبؤ بتأثير إيجابي للعلاج. ومن أهم مزايا علاج السوماتوتروبين عدم تسارع عملية تعظم الهيكل العظمي في ظل تأثيره.
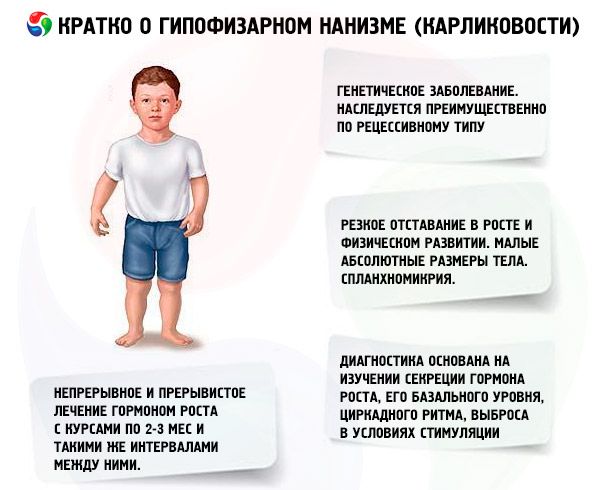
أهم وسيلة لعلاج التقزم هي استخدام المنشطات الابتنائية ، التي تحفز النمو عن طريق تعزيز تخليق البروتين وزيادة مستوى هرمون النمو الداخلي. يتم إجراء العلاج لعدة سنوات، مع استبدال بعض الأدوية تدريجيًا بأخرى، من مركبات أقل نشاطًا إلى مركبات أكثر نشاطًا. يُشار إلى تغيير الأدوية الابتنائية عندما ينخفض تأثير النمو بعد 2-3 سنوات، مما يؤدي إلى زيادة إضافية في النمو. يتم العلاج على دورات (يجب أن تكون فترة الراحة نصف فترة العلاج). في حالة الإدمان، يشار أيضًا إلى فترات راحة أطول (تصل إلى 4-6 أشهر). يُوصف واحد فقط من المنشطات الابتنائية في كل مرة. الجمع بين دوائين أو أكثر غير مناسب، لأن هذا لا يعزز آثارهما الأيضية والنمو. يعتمد الأخير في المقام الأول على عمر المرضى ودرجة تمايز العظام الهيكلية في بداية العلاج. يُلاحظ أفضل تأثير لدى المرضى الذين تقل أعمارهم عن 16-18 عامًا والذين لا يتجاوز تعظم الهيكل العظمي المستوى المميز لشخص يبلغ من العمر 14 عامًا. يُنصح ببدء العلاج فورًا بعد التشخيص، عادةً من سن 5-7 سنوات. قبل العلاج، من الضروري تجنب وصف الجونادوتروبينات والهرمونات الجنسية، والتي تعمل في الوقت نفسه على تحفيز النمو وتسريع التمايز الهيكلي. مبدأ جرعات المنشطات الابتنائية هو من الحد الأدنى للجرعات الفعالة إلى الجرعات المتزايدة تدريجيًا. الجرعات الموصى بها من الأدوية الأكثر شيوعًا: نيروبول (ميثاندروستينول، ديانابول) - 0.1-0.15 مجم لكل 1 كجم من وزن الجسم يوميًا عن طريق الفم؛ نيروبوليل (دورابولين) - 1 مجم لكل 1 كجم من وزن الجسم شهريًا عن طريق الحقن العضلي، تُعطى الجرعة الشهرية على 2-3 جرعات، على التوالي، بعد 15 أو 10 أيام؛ ريتابوليل (ديكا-دورابولين) - ١ ملغ لكل ١ كجم من وزن الجسم، مرة واحدة شهريًا، عن طريق الحقن العضلي. قد يؤدي تجاوز الجرعات المحددة إلى زيادة الأندروجين. عند تناولها بجرعات فسيولوجية، لا تؤثر هذه المركبات بشكل كبير على حالة الأعضاء التناسلية وتمايز العظام الهيكلية، مما يسمح باستخدامها لفترة طويلة لدى المرضى من كلا الجنسين. يجب أن تكون الفتيات تحت إشراف طبيب أمراض نسائية، لأنه في حالة الجرعة الزائدة أو زيادة الحساسية الفردية، قد تظهر لدى بعض المرضى علامات ذكورة، والتي تتراجع بسرعة عند التوقف عن العلاج. قد تسبب الأدوية الفموية الميثيلية إلى الميثيلية في الموقع ١٧ أحيانًا تأثيرًا ركوديًا، لذلك، في حالات أمراض الكبد، يجب إعطاء الأفضلية للمركبات الابتنائية الوريدية، أو الجمع بين الأدوية الفموية وعوامل مفرزات الصفراء. في حالات نادرة جدًا، قد يسبب العلاج بالستيرويدات الابتنائية ردود فعل تحسسية (حكة، طفح جلدي). في حال عدم وجود مضاعفات، تُستخدم المنشطات الابتنائية طالما استمر تأثير النمو (حتى عمر ١٦-١٨ عامًا، وأحيانًا أطول). يُجرى العلاج بالتزامن مع جلسات تقوية عامة.
إذا ظهرت على المرضى علامات قصور الغدة الدرقية، يتم وصف أدوية الغدة الدرقية (الثيروكسين، الثايرويدين، الثيروتون) في وقت واحد بجرعات محددة بشكل فردي.
في علاج الأولاد، تتمثل الخطوة التالية في إعطاء موجهة الغدد التناسلية المشيمية البشرية. يُستخدم هذا الدواء في سن لا يتجاوز 15-16 عامًا، وغالبًا في سن أكبر، لتحفيز خلايا لايديغ، مما يُسرّع النمو والتطور الجنسي (بفضل النشاط الابتنائي للأندروجينات الخاصة بها). تُعطى جرعات تتراوح بين 1000 و1500 وحدة دولية مرة أو مرتين أسبوعيًا عن طريق الحقن العضلي في دورات مدتها شهران، ولا تتجاوز مرتين أو ثلاث مرات سنويًا. في حال عدم اكتمال التأثير، يُعطى علاج موجهة الغدد التناسلية المشيمية البشرية للأولاد الذين تبلغ أعمارهم 16 عامًا فأكثر بالتناوب مع إعطاء جرعات صغيرة من الأندروجينات (ميثيل تستوستيرون بجرعة 5-10 ملغ/يوم تحت اللسان).
يمكن للفتيات فوق سن السادسة عشرة بدء العلاج بجرعات صغيرة من الإستروجين، مما يُحاكي الدورة الجنسية الطبيعية. يُجرى العلاج لمدة ثلاثة أسابيع من كل شهر، تليها فترة راحة. في المرحلة الثانية من الدورة، بدءًا من الأسبوع الثالث، يمكن وصف مُوَجِّهَةُ الغُدَدِ التَّنَاسُلِيَّةِ المَشْيَمِيَّة بجرعة تتراوح بين 1000 و1500 وحدة دولية، 3-5 مرات أسبوعيًا، أو أدوية ذات تأثير مُنَشِّط (مثل: بريجِن، بروجستيرون).
المرحلة الأخيرة من العلاج (بعد إغلاق مناطق النمو) هي إعطاء جرعات علاجية منتظمة من الهرمونات الجنسية المناسبة لجنس المريض، وذلك بهدف تطوير الأعضاء التناسلية والخصائص الجنسية الثانوية بشكل كامل، وضمان الرغبة الجنسية والقدرة الجنسية. تُعدّ مستحضرات الإستروجين والبروجيستوجين المركبة (غير الأوفلون، بيسيكورين، إنفيكوندين، ريجيفيدون) مناسبة لعلاج المريضات، بينما تُعدّ مستحضرات الأندروجين ممتدة المفعول (تيستينات، سوستانون-250، أومنادرين-250) مناسبة لعلاج المرضى الذكور.
يُجرى علاج تقوية عام (نظام غذائي، نظام غذائي غني بالبروتين والخضراوات، علاج بالفيتامينات، منشطات حيوية). يُنصح باستخدام مستحضرات الزنك، التي تعتمد آلية عملها بشكل رئيسي على زيادة نشاط عامل النمو الشبيه بالأنسولين IGF-1.
في حال وجود أمراض عضوية في الجهاز العصبي المركزي، يُعطى علاج مضاد للالتهابات، وعلاج امتصاصي، وعلاج للجفاف. يُعطي العلاج المنهجي المُستهدف تأثيرًا مُشجعًا. نتيجةً للعلاج المُتدرج طويل الأمد، تمكن 148 مريضًا (80.4%) من أصل 175 مريضًا مُصابًا بالتقزم من كلا الجنسين من الوصول إلى طول يزيد عن 130 سم، و92 مريضًا (52.5%) - أكثر من 140 سم، و32 مريضًا (18.3%) - 150-160 سم أو أكثر. في الوقت نفسه، زاد طول 37 مريضًا (21.2%) بمقدار 30 سم، و107 مرضى (61.1%) بمقدار 31-50 سم، و31 مريضًا (17.7%) بمقدار 51-60 سم أو أكثر.
توقعات
يعتمد تشخيص التقزم على شكله. في الأنواع الوراثية من التقزم، يكون تشخيص الحياة مواتياً. في حال وجود ورم في الغدة النخامية وتلف عضوي في الجهاز العصبي المركزي، يُحدد ذلك من خلال ديناميكيات تطور العملية المرضية الرئيسية. وقد أدت أساليب العلاج الحديثة إلى تحسين القدرات البدنية والقدرة على العمل لدى المرضى بشكل ملحوظ، وإطالة متوسط أعمارهم. خلال فترة العلاج النشط، يحتاج المرضى إلى فحص طبي كل شهرين إلى ثلاثة أشهر، مع العلاج الداعم كل ستة إلى اثني عشر شهراً.
إن توظيف المرضى بما يتناسب مع قدراتهم الفكرية والجسدية له أهمية قصوى في تكيفهم الاجتماعي.
من المستحسن اختيار المهن التي لا تتطلب مجهودًا بدنيًا شاقًا، ولكنها تسمح لك بإظهار القدرات الفكرية، والقدرة على القيام بأعمال دقيقة، واللغات.


 [
[