خبير طبي في المقال
منشورات جديدة
تخليق الكاتيكولامينات وإفرازها واستقلابها
آخر مراجعة: 06.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
يُنتج نخاع الغدة الكظرية مركبات ذات بنية مختلفة تمامًا عن الستيرويدات. تحتوي هذه المركبات على نواة 3،4-ثنائي هيدروكسي فينيل (كاتيكول) وتُسمى الكاتيكولامينات. وتشمل هذه المركبات الأدرينالين والنورادرينالين والدوبامين بيتا هيدروكسي تايرامين.
تسلسل تخليق الكاتيكولامينات بسيط للغاية: تيروزين ← ثنائي هيدروكسي فينيل ألانين (دوبا) ← دوبامين ← نورإبينفرين ← أدرينالين. يدخل التيروزين الجسم مع الطعام، ويمكن أيضًا أن يتكون من فينيل ألانين في الكبد تحت تأثير فينيل ألانين هيدروكسيلاز. تختلف النواتج النهائية لتحويل التيروزين في الأنسجة. في نخاع الغدة الكظرية، تستمر العملية حتى مرحلة تكوين الأدرينالين، وفي نهايات الأعصاب الودية - نورإبينفرين. في بعض عصبونات الجهاز العصبي المركزي، ينتهي تخليق الكاتيكولامينات بتكوين الدوبامين.
يُحفَّز تحويل التيروزين إلى دوبا بواسطة إنزيم تيروزين هيدروكسيلاز، الذي تُعدّ عوامله المساعدة رباعي هيدرو بيوبترين والأكسجين. يُعتقد أن هذا الإنزيم يحدّ من سرعة عملية تخليق الكاتيكولامين بأكملها، وتُثبَّطه النواتج النهائية للعملية. يُعدّ تيروزين هيدروكسيلاز الهدف الرئيسي للتأثيرات التنظيمية على تخليق الكاتيكولامين.
يُحفَّز تحويل الدوبا إلى دوبامين بواسطة إنزيم دوبا ديكاربوكسيلاز (العامل المساعد - فوسفات البيريدوكسال)، وهو إنزيم غير نوعي نسبيًا، ويُزيل الكربوكسيل من الأحماض الأمينية العطرية الأخرى من نوع L. ومع ذلك، هناك مؤشرات على إمكانية تعديل تخليق الكاتيكولامينات بتغيير نشاط هذا الإنزيم. تفتقر بعض الخلايا العصبية إلى إنزيمات لمواصلة تحويل الدوبامين، وهو المنتج النهائي. تحتوي أنسجة أخرى على بيتا هيدروكسيلاز الدوبامين (العوامل المساعدة - النحاس، وحمض الأسكوربيك، والأكسجين)، الذي يُحوِّل الدوبامين إلى نورإبينفرين. يوجد في نخاع الغدة الكظرية (ولكن ليس في نهايات الأعصاب الودية)، فينيل إيثانولامين - وهو ميثيل ترانسفيراز يُكوِّن الأدرينالين من النورإبينفرين. في هذه الحالة، يعمل S-أدينوسيل ميثيونين كمُعطي لمجموعات الميثيل.
من المهم تذكر أن تخليق فينيل إيثانولامين-N-ميثيل ترانسفيراز يتم عن طريق دخول الجلوكوكورتيكويدات إلى النخاع من القشرة عبر الجهاز الوريدي البابي. قد يفسر هذا وجود غدتين صماء مختلفتين في عضو واحد. وتتجلى أهمية الجلوكوكورتيكويدات في تخليق الأدرينالين في أن خلايا النخاع الكظري التي تنتج النورأدرينالين تقع حول الأوعية الدموية الشريانية، بينما تتلقى الخلايا المنتجة للأدرينالين الدم بشكل رئيسي من الجيوب الوريدية الموجودة في قشرة الغدة الكظرية.
يحدث تحلل الكاتيكولامينات بشكل رئيسي تحت تأثير نظامين إنزيميين: كاتيكول-O-ميثيل ترانسفيراز (COMT) وأوكسيديز أحادي الأمين (MAO). يوضح الشكل 54 المسارات الرئيسية لتحلل الأدرينالين والنورادرينالين بشكل تخطيطي. تحت تأثير COMT، وفي وجود S-أدرينوسيل ميثيونين، مانح مجموعة الميثيل، تتحول الكاتيكولامينات إلى نورميتانفرين وميتانفرين (مشتقات 3-O-ميثيل من النورأدرينالين والأدرينالين)، والتي تتحول بدورها، تحت تأثير MAO، إلى ألدهيدات، ثم (بوجود أوكسيديز الألدهيد) إلى حمض الفانيليل ماندليك (VMA)، وهو الناتج الرئيسي لتحلل النورأدرينالين والأدرينالين. في الحالة نفسها، عند تعرض الكاتيكولامينات مبدئيًا لـ MAO بدلًا من COMT، فإنها تتحول إلى ألدهيد 3,4-دايوكسومانديليك، ثم، بتأثير أوكسيديز الألدهيد وCOMT، إلى حمض 3,4-دايوكسومانديليك وVMC. في وجود كحول نازعة الهيدروجين، يمكن أن يتكون من الكاتيكولامينات 3-ميثوكسي-4-أوكسي فينيل جليكول، وهو الناتج النهائي الرئيسي لتحلل الأدرينالين والنورادرينالين في الجهاز العصبي المركزي.
إن تحلل الدوبامين مشابه، إلا أن مستقلباته تفتقر إلى المجموعة الهيدروكسيل في ذرة بيتا الكربون، وبالتالي، بدلاً من حمض الفانيليل ماندليك، يتم تكوين حمض الهوموفانيليك (HVA) أو حمض 3-ميثوكسي-4-هيدروكسي فينيل أسيتيك.
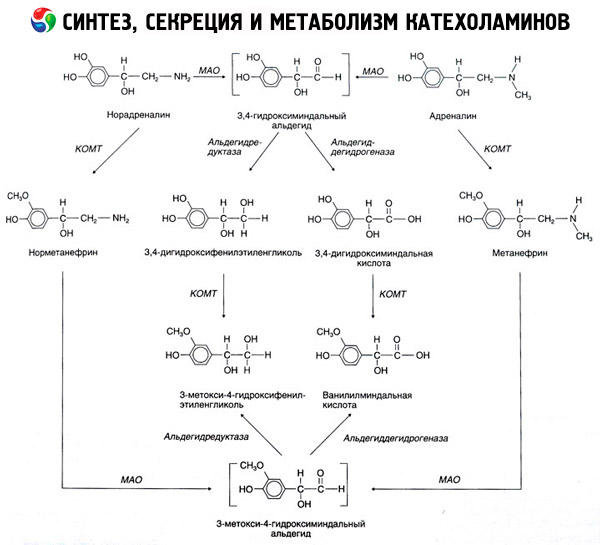
كما تم افتراض وجود مسار كينويدي لأكسدة جزيء الكاتيكولامين، والذي قد ينتج عنه منتجات وسيطة ذات نشاط بيولوجي واضح.
يدخل النورإبينفرين والأدرينالين، المتكونان بفعل إنزيمات السيتوبلازم في النهايات العصبية الودية ونخاع الغدة الكظرية، إلى الحبيبات الإفرازية، مما يحميهما من تأثير إنزيمات التحلل. يتطلب التقاط الكاتيكولامينات بواسطة الحبيبات إنفاق طاقة. في حبيبات الكرومافين في نخاع الغدة الكظرية، ترتبط الكاتيكولامينات ارتباطًا وثيقًا بـ ATP (بنسبة 4:1) وبروتينات محددة - الكروموجرانينات، مما يمنع انتشار الهرمونات من الحبيبات إلى السيتوبلازم.
يبدو أن المحفز المباشر لإفراز الكاتيكولامينات هو اختراق الكالسيوم إلى داخل الخلية، مما يحفز الإخراج الخلوي (اندماج الغشاء الحبيبي مع سطح الخلية وتمزقه مع الإطلاق الكامل للمحتويات القابلة للذوبان - الكاتيكولامينات، ودوبامين بيتا هيدروكسيلاز، وATP، والكروموجرانين - في السائل خارج الخلية).
التأثيرات الفسيولوجية للكاتيكولامينات وآلية عملها
تبدأ تأثيرات الكاتيكولامينات بالتفاعل مع مستقبلات محددة في الخلايا المستهدفة. فبينما تتواجد مستقبلات هرمونات الغدة الدرقية والستيرويد داخل الخلايا، تتواجد مستقبلات الكاتيكولامينات (وكذلك هرمونات الأستيل كولين والببتيد) على السطح الخارجي للخلية.
لقد ثبت منذ زمن طويل أن الأدرينالين أو النورأدرينالين أكثر فعالية من الكاتيكولامين الاصطناعي إيزوبروتيرينول في بعض التفاعلات، بينما يتفوق إيزوبروتيرينول على الأدرينالين أو النورأدرينالين في تفاعلات أخرى. بناءً على ذلك، طُوّر مفهوم وجود نوعين من المستقبلات الأدرينالية في الأنسجة: ألفا وبيتا، وفي بعض هذه الأنسجة لا يوجد سوى نوع واحد منهما. يُعد إيزوبروتيرينول أقوى ناهض لمستقبلات بيتا الأدرينالية، بينما يُعد المركب الاصطناعي فينيليفرين أقوى ناهض لمستقبلات ألفا الأدرينالية. تستطيع الكاتيكولامينات الطبيعية - الأدرينالين والنورأدرينالين - التفاعل مع كلا النوعين من المستقبلات، إلا أن الأدرينالين يُظهر انجذابًا أكبر لمستقبلات بيتا، بينما يُظهر النورأدرينالين انجذابًا أكبر لمستقبلات ألفا.
تُنشّط الكاتيكولامينات مستقبلات بيتا الأدرينالية القلبية بشكل أقوى من مستقبلات بيتا في العضلات الملساء، مما سمح بتقسيم نوع بيتا إلى أنواع فرعية: مستقبلات بيتا1 (القلب، الخلايا الدهنية)، ومستقبلات بيتا2 (الشعب الهوائية، الأوعية الدموية، إلخ). يفوق تأثير الإيزوبروترينول على مستقبلات بيتا1 تأثير الأدرينالين والنورادرينالين بعشر مرات فقط، بينما يكون تأثيره على مستقبلات بيتا2 أقوى بـ 100-1000 مرة من الكاتيكولامينات الطبيعية.
أكد استخدام مضادات محددة (فينتولامين وفينوكسي بنزامين لمستقبلات ألفا، وبروبرانولول لمستقبلات بيتا) صحة تصنيف مستقبلات الأدرينالية. يتفاعل الدوبامين مع كلٍّ من مستقبلات ألفا وبيتا، إلا أن أنسجة مختلفة (الدماغ، والغدة النخامية، والأوعية الدموية) تمتلك أيضًا مستقبلات دوبامينية خاصة بها، والعامل الحاسم لها هو هالوبيريدول. يتراوح عدد مستقبلات بيتا بين 1000 و2000 مستقبل لكل خلية. عادةً ما ترتبط التأثيرات البيولوجية للكاتيكولامينات التي تتوسطها مستقبلات بيتا بتنشيط أدينيلات سيكليز وزيادة المحتوى داخل الخلايا من cAMP. على الرغم من أن المستقبل والإنزيم مرتبطان وظيفيًا، إلا أنهما جزيئات كبيرة مختلفة. يشارك ثلاثي فوسفات الغوانوزين (GTP) ونيوكليوتيدات البيورين الأخرى في تعديل نشاط أدينيلات سيكليز بتأثير مُركّب الهرمون-المستقبل. ويبدو أن زيادة نشاط الإنزيم تُقلل من تقارب مستقبلات بيتا مع المُنشِّطات.
ظاهرة زيادة حساسية البنى غير المُعَصَّبة معروفة منذ زمن طويل. على العكس من ذلك، يُقلِّل التعرض المُطوّل للناهضات من حساسية الأنسجة المُستهدفة. وقد أتاحت دراسة مُستقبلات بيتا تفسير هذه الظاهرة. وقد تبيّن أن التعرض المُطوّل للإيزوبروتيرينول يُؤدي إلى فقدان حساسية أدينيلات سيكليز نتيجةً لانخفاض عدد مُستقبلات بيتا.
لا تتطلب عملية إزالة التحسس تنشيط تخليق البروتين، وربما ترجع إلى التكوين التدريجي لمجمعات مستقبلات هرمونية غير رجعية. على العكس من ذلك، فإن إدخال 6-أوكسيدوبامين، الذي يُدمر النهايات الودية، يصاحبه زيادة في عدد مستقبلات بيتا المتفاعلة في الأنسجة. ومن المحتمل أن تؤدي زيادة نشاط الجهاز العصبي الودي أيضًا إلى إزالة تحسس الأوعية الدموية والأنسجة الدهنية تجاه الكاتيكولامينات المرتبطة بالعمر.
يمكن التحكم في عدد المستقبلات الأدرينالية في مختلف الأعضاء بواسطة هرمونات أخرى. وبالتالي، يزيد الإستراديول بينما يقلل البروجسترون من عدد مستقبلات ألفا الأدرينالية في الرحم، ويصاحب ذلك زيادة ونقصان في استجابتها الانقباضية للكاتيكولامينات. إذا كان "الرسول الثاني" داخل الخلايا، الناتج عن عمل منبهات مستقبلات بيتا، هو cAMP، فإن الوضع فيما يتعلق بناقل تأثيرات ألفا الأدرينالية يكون أكثر تعقيدًا. يُفترض وجود آليات مختلفة: انخفاض مستوى cAMP، وزيادة محتواه، وتعديل ديناميكيات الكالسيوم الخلوية، إلخ.
لإحداث تأثيرات مختلفة في الجسم، عادةً ما تكون جرعات الأدرينالين المطلوبة أقل بـ 5-10 مرات من النورأدرينالين. على الرغم من أن الأخير أكثر فعالية فيما يتعلق بمستقبلات ألفا وبيتا-1 الأدرينالية، فمن المهم تذكر أن كلا الكاتيكولامينات الداخلية قادرة على التفاعل مع مستقبلات ألفا وبيتا. لذلك، تعتمد الاستجابة البيولوجية لأي عضو للتنشيط الأدرينالي بشكل كبير على نوع المستقبلات الموجودة فيه. ومع ذلك، هذا لا يعني استحالة التنشيط الانتقائي للرابط العصبي أو الخلطي للجهاز الودي-الكظري. في معظم الحالات، يُلاحظ زيادة في نشاط روابطه المختلفة. وبالتالي، من المتفق عليه عمومًا أن نقص سكر الدم ينشط نخاع الغدة الكظرية انعكاسيًا، بينما يصاحب انخفاض ضغط الدم (انخفاض ضغط الدم الوضعي) بشكل رئيسي إطلاق النورأدرينالين من نهايات الأعصاب الودية.
المستقبلات الأدرينالية وتأثيرات تنشيطها في الأنسجة المختلفة
الجهاز، العضو |
نوع مستقبلات الأدرينالية |
رد فعل |
الجهاز القلبي الوعائي: |
||
قلب |
بيتا |
زيادة معدل ضربات القلب والتوصيل والانقباض |
الشرايين الصغيرة: |
||
الجلد والأغشية المخاطية |
ألفا |
تخفيض |
العضلات الهيكلية |
بيتا |
التوسع والانكماش |
أعضاء البطن |
ألفا (المزيد) |
تخفيض |
بيتا |
امتداد |
|
الأوردة |
ألفا |
تخفيض |
الجهاز التنفسي: |
||
عضلات الشعب الهوائية |
بيتا |
امتداد |
الجهاز الهضمي: |
||
معدة |
بيتا |
انخفاض المهارات الحركية |
أمعاء |
ألفا |
انقباض العضلات العاصرة |
الطحال |
ألفا |
تخفيض |
بيتا |
الاسترخاء |
|
البنكرياس الخارجي |
ألفا |
انخفاض الإفراز |
الجهاز البولي التناسلي: |
ألفا |
انقباض العضلة العاصرة |
المثانة |
بيتا |
استرخاء العضلة القاذفة |
الأعضاء التناسلية الذكرية |
ألفا |
القذف |
عيون |
ألفا |
اتساع حدقة العين |
جلد |
ألفا |
زيادة التعرق |
الغدد اللعابية |
ألفا |
إخراج البوتاسيوم والماء |
بيتا |
إفراز الأميليز |
|
الغدد الصماء: |
||
جزر البنكرياس |
||
خلايا بيتا |
ألفا (المزيد) |
انخفاض إفراز الأنسولين |
بيتا |
زيادة إفراز الأنسولين |
|
خلايا ألفا |
بيتا |
زيادة إفراز الجلوكاجون |
8 خلايا |
بيتا |
زيادة إفراز السوماتوستاتين |
المهاد والغدة النخامية: |
||
الكائنات الحية الدقيقة الجسدية |
ألفا |
زيادة إفراز هرمون الاستروجين |
بيتا |
انخفاض إفراز هرمون ستروماتاز |
|
اللاكتوتروفات |
ألفا |
انخفاض إفراز هرمون البرولاكتين |
ثيروتروفات |
ألفا |
انخفاض إفراز هرمون TSH |
الكورتيكوتروفات |
ألفا |
زيادة إفراز هرمون ACTH |
| بيتا | انخفاض إفراز ACTH | |
الغدة الدرقية: |
||
الخلايا الجريبية |
ألفا |
انخفاض إفراز هرمون الثيروكسين |
بيتا |
زيادة إفراز هرمون الثيروكسين |
|
الخلايا المجاورة للجريب (K) |
بيتا |
زيادة إفراز الكالسيتونين |
الغدد جارات الدرقية |
بيتا |
زيادة إفراز هرمون الغدة جار الدرقية |
الكلى |
بيتا |
زيادة إفراز الرينين |
معدة |
بيتا |
زيادة إفراز الجاسترين |
بي اكس |
بيتا |
زيادة استهلاك الأكسجين |
الكبد |
؟ |
زيادة تحلل الجليكوجين وتكوين الجلوكوز مع إطلاق الجلوكوز؛ وزيادة تكوين الكيتون مع إطلاق أجسام الكيتون |
الأنسجة الدهنية |
بيتا |
زيادة تحلل الدهون مع إطلاق الأحماض الدهنية الحرة والجلسرين |
العضلات الهيكلية |
بيتا |
زيادة تحلل الجلوكوز مع إطلاق البيروفات واللاكتات؛ انخفاض تحلل البروتين مع انخفاض إطلاق الألانين والجلوتامين |
من المهم مراعاة أن نتائج إعطاء الكاتيكولامينات عن طريق الوريد لا تعكس دائمًا تأثيرات المركبات الداخلية بشكل كافٍ. ينطبق هذا بشكل رئيسي على النورإبينفرين، لأنه يُطلق في الجسم مباشرةً في الشقوق المشبكية، وليس في الدم. لذلك، يُنشّط النورإبينفرين الداخلي، على سبيل المثال، ليس فقط مستقبلات ألفا الوعائية (ارتفاع ضغط الدم)، بل أيضًا مستقبلات بيتا في القلب (زيادة معدل ضربات القلب)، بينما يؤدي إدخال النورإبينفرين من الخارج بشكل رئيسي إلى تنشيط مستقبلات ألفا الوعائية وإبطاء نبضات القلب بشكل انعكاسي (عبر العصب المبهم).
تُنشّط الجرعات المنخفضة من الأدرينالين مستقبلات بيتا في الأوعية العضلية والقلب بشكل رئيسي، مما يؤدي إلى انخفاض في مقاومة الأوعية الدموية الطرفية وزيادة في النتاج القلبي. في بعض الحالات، قد يسود التأثير الأولي، ويتطور انخفاض ضغط الدم بعد إعطاء الأدرينالين. أما في الجرعات العالية، فينشّط الأدرينالين أيضًا مستقبلات ألفا، وهو ما يصاحبه زيادة في مقاومة الأوعية الدموية الطرفية، ويؤدي، على خلفية زيادة في النتاج القلبي، إلى زيادة في ضغط الدم الشرياني. ومع ذلك، يبقى تأثيره على مستقبلات بيتا الوعائية محفوظًا أيضًا. ونتيجة لذلك، يتجاوز ارتفاع الضغط الانقباضي المؤشر المماثل للضغط الانبساطي (زيادة في ضغط النبض). ومع إدخال جرعات أعلى، تبدأ تأثيرات الأدرينالين المحاكية لألفا في الظهور: يرتفع الضغط الانقباضي والانبساطي بالتوازي، كما هو الحال تحت تأثير النورإبينفرين.
يتألف تأثير الكاتيكولامينات على عملية الأيض من تأثيرات مباشرة وغير مباشرة. تتحقق التأثيرات المباشرة بشكل رئيسي من خلال مستقبلات بيتا. أما العمليات الأكثر تعقيدًا فترتبط بالكبد. على الرغم من أن زيادة تحلل الجليكوجين في الكبد يُعتقد تقليديًا أنها نتيجة لتنشيط مستقبلات بيتا، إلا أن هناك أدلة على تورط مستقبلات ألفا. ترتبط التأثيرات غير المباشرة للكاتيكولامينات بتعديل إفراز العديد من الهرمونات الأخرى، مثل الأنسولين. في تأثير الأدرينالين على إفرازه، يسود عنصر ألفا الأدرينالي بشكل واضح، حيث ثبت أن أي إجهاد يصاحبه تثبيط إفراز الأنسولين.
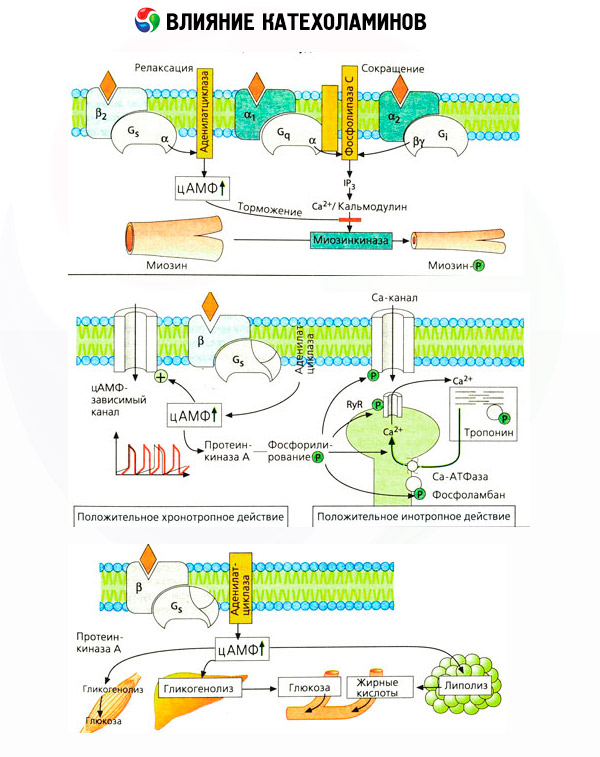
يؤدي الجمع بين التأثيرات المباشرة وغير المباشرة للكاتيكولامينات إلى ارتفاع سكر الدم، والذي لا يقتصر على زيادة إنتاج الجلوكوز الكبدي فحسب، بل يشمل أيضًا تثبيط استخدامه في الأنسجة الطرفية. ويؤدي تسريع تحلل الدهون إلى ارتفاع مستوى حمض الليبويك في الدم، مع زيادة توصيل الأحماض الدهنية إلى الكبد وتكثيف إنتاج أجسام الكيتون. ويؤدي تزايد تحلل الجلوكوز في العضلات إلى زيادة إطلاق اللاكتات والبيروفات في الدم، واللذين يعملان، إلى جانب الجلسرين المنطلق من الأنسجة الدهنية، كمقدمات لعملية تكوين الجلوكوز في الكبد.
تنظيم إفراز الكاتيكولامينات. شكّل تشابه نواتج وطرق تفاعل الجهاز العصبي الودي ونخاع الغدة الكظرية أساسًا لدمج هذه الهياكل في جهاز ودي-كظري واحد في الجسم، مع توزيع روابطه العصبية والهرمونية. تتركز الإشارات الواردة المختلفة في منطقة ما تحت المهاد ومراكز النخاع الشوكي والنخاع المستطيل، حيث تنبع الرسائل الصادرة، وتنتقل إلى الأجسام الخلوية للخلايا العصبية قبل العقدية الموجودة في القرون الجانبية للحبل الشوكي عند مستوى الفقرات العنقية الثامنة - القطنية الثانية والثالثة.
تخرج المحاور العصبية قبل العقدية لهذه الخلايا من النخاع الشوكي، مُشكِّلةً روابط تشابكية مع الخلايا العصبية الموجودة في عقد السلسلة الودية أو مع خلايا لب الغدة الكظرية. هذه الألياف قبل العقدية كولينية. يتمثل الاختلاف الجوهري الأول بين الخلايا العصبية الودية بعد العقدية وخلايا الكرومافين في لب الغدة الكظرية في أن الأخيرة لا تنقل الإشارة الكولينية التي تستقبلها عن طريق التوصيل العصبي (الأعصاب الأدرينالية بعد العقدية)، بل عن طريق المسار الخلطي، مُطلقةً مركبات أدرينالية في الدم. أما الاختلاف الثاني، فهو أن الأعصاب بعد العقدية تُنتج النورإبينفرين، بينما تُنتج خلايا لب الغدة الكظرية الأدرينالين بشكل رئيسي. هاتان المادتان لهما تأثيرات مختلفة على الأنسجة.

