خبير طبي في المقال
منشورات جديدة
داء الكلب عند الأطفال
آخر مراجعة: 04.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
داء الكلب أو داء الكلب هو مرض فيروسي حاد ينتقل عن طريق عضة حيوان مصاب، ويؤدي إلى تلف الجهاز العصبي وتطور التهاب الدماغ الشديد مع نتيجة مميتة.
علم الأوبئة
يُعدّ فيروس داء الكلب آفةً صحيةً عامةً منذ القدم، إذ يُسبب حاليًا ما يقارب 59,000 حالة وفاة بشرية سنويًا، تنتقل جميعها تقريبًا عن طريق عضات الكلاب. ولهذا تأثيرٌ اقتصاديٌّ كبيرٌ على الدول النامية، وخاصةً في أفريقيا وآسيا، التي يُمكنها تحمّل أقلّ الخسائر. ومع ذلك، ورغم أن مُعدّل الوفيات فيه يقارب 100%، فإنّ داء الكلب الكلبي مرضٌ يُمكن الوقاية منه تمامًا، وتشهد على ذلك الأمثلة التاريخية للقضاء على داء الكلب الكلبي في العالم المُتقدّم. [ 1 ]
الأسباب داء الكلب
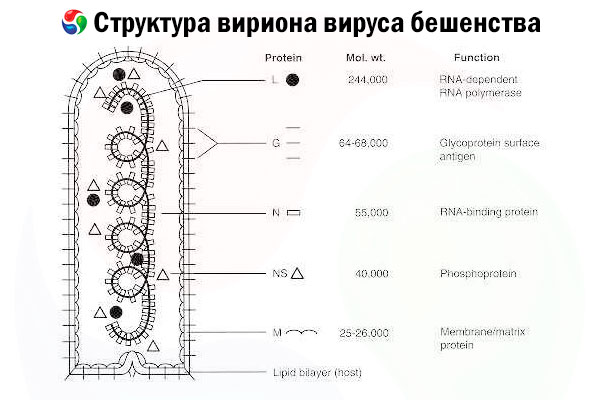
العامل المسبب هو فيروس داء الكلب (RV)، وهو فيروس RNA سلبي السلسلة من عائلة الفيروسات الربدية ، ويبلغ حجمه حوالي 60 نانومتر × 180 نانومتر.
يتكون من نواة بروتينية داخلية، أو غلاف نووي، تحتوي على حمض نووي، وغشاء خارجي، وهو طبقة ثنائية تحتوي على دهون مغطاة بمسامير من جليكوبروتين عبر الغشاء. يتميز ببنية جينومية معيارية بسيطة نسبيًا، ويُشفّر خمسة بروتينات هيكلية:
- بوليميراز الحمض النووي الريبي المعتمد على الحمض النووي الريبي (L)،
- النوكليوبروتين (N)،
- البروتين المفسفر (P)،
- بروتين المصفوفة (M) و
- جليكوبروتين السطح الخارجي (G).
تُشكّل بروتينات N وP وL، إلى جانب الحمض النووي الريبوزي الجينومي، مُركّب الريبونوكليوبروتين. يُعدّ G مُستضد الفيروس اللمفاوي الوحيد القادر على تحفيز إنتاج الأجسام المضادة المُحيّدة للفيروس اللمفاوي، وهي العوامل المناعية الرئيسية المُؤثرة ضد عدوى الفيروس اللمفاوي القاتلة. من ناحية أخرى، ثَبُتَ أن مُركّب الريبونوكليوبروتين هو مُستضد الفيروس اللمفاوي الرئيسي القادر على تحفيز الخلايا التائية CD4+، والتي يُمكن أن تُعزّز إنتاج الأجسام المضادة المُحيّدة للفيروس اللمفاوي من خلال التعرّف على المُستضد داخل البنية.[ 2 ] قد يلعب مُركّب الريبونوكليوبروتين دورًا هامًا في بناء الذاكرة المناعية والمناعة طويلة الأمد.[ 3 ]
التصنيف وأنواع المستضدات
يشمل جنس فيروس ليسا فيروس داء الكلب وفيروسات داء الكلب المرتبطة به وراثيًا ومستضديًا: فيروسات خفافيش لاغوس، وموكولا، ودوفينهاج، بالإضافة إلى نوعين فرعيين مفترضين من فيروسات ليسا الخفافيش الأوروبية. تشير دراسات الحماية المتقاطعة إلى أن الحيوانات المُحصنة بلقاحات داء الكلب التقليدية قد لا تتمتع بحماية كاملة عند مواجهتها بفيروسات ليسا أخرى.
يمكن تصنيف فيروسات داء الكلب إلى فيروسات ثابتة (متكيّفة بالانتقال بين الحيوانات أو زراعة الخلايا) أو فيروسات برية (من النوع البري). وقد ساعد استخدام الأجسام المضادة وحيدة النسيلة والتسلسل الجيني للتمييز بين فيروسات داء الكلب في تحديد المتغيرات الفيروسية التي تنشأ من مستودعات رئيسية حول العالم، وفي اقتراح مصادر محتملة للتعرض البشري في حال غياب تاريخ مؤكد لعضة حيوانية في حالة المريض.[ 8 ]
طريقة تطور المرض
تُعدّ الذئاب والثعالب وابن آوى والخفافيش المصدر الرئيسي للعدوى بين الحيوانات البرية، وكذلك بين الحيوانات الأليفة - الكلاب والقطط، ونادرًا - الخيول والأبقار والخنازير والجرذان، وغيرها. ويُعدّ انتقال العدوى من شخص لآخر، وإن كان ممكنًا، نادرًا للغاية. ويُعدّ هذا النوع من العدوى حيواني المنشأ. ويُصاب الناس بداء الكلب بشكل رئيسي من الكلاب.
بعد أن يعض إنسان من حيوان مريض، يتكاثر الفيروس في الأنسجة العضلية في موقع العضة، وبعد ذلك، بعد أن يصل إلى نهايات الأعصاب الطرفية الحسية، ينتشر مركزيًا، ويصل إلى الخلايا العصبية الحركية. يعتمد الوقت الذي يستغرقه الفيروس للتحرك والتأثر بالدماغ على موقع العضة. في حالة العضات الشديدة في الرأس والوجه، يمكن أن يصل الفيروس إلى الجهاز العصبي المركزي في غضون 15-20 يومًا، وفي حالة حدوث ضرر طفيف في جلد الجذع والأطراف، وبالتالي جرعة صغيرة من العامل الممرض، يمكن أن تتأخر عملية نقل الفيروس إلى الجهاز العصبي المركزي لعدة أشهر أو حتى تصل إلى 1-1.5 سنة. بعد وصوله إلى الجهاز العصبي المركزي، يتم تثبيت الفيروس في أنسجة الدماغ والحبل الشوكي، وخاصة في الخلايا العصبية في النخاع المستطيل وقرن آمون وقاعدة الدماغ. في الحبل الشوكي، تتأثر القرون الخلفية بشكل أكبر. من الجهاز العصبي المركزي، ينتقل الفيروس بشكل طردي على طول جذوع الأعصاب إلى الغدد اللعابية، حيث يتكاثر ويخرج مع اللعاب.
مفاهيم في مسببات داء الكلب
يمتلك فيروس داء الكلب نطاقًا واسعًا من العوائل، ويمكنه إصابة جميع الثدييات تقريبًا. على الرغم من الإبلاغ عن عدة طرق لانتقال فيروس داء الكلب، إلا أن العدوى الطبيعية تحدث غالبًا عن طريق اللدغة. بالإضافة إلى اللدغات، يمكن أن يعزز تناول جثث مصابة بفيروس داء الكلب إصابة ثعالب القطب الشمالي، كما وُجد أن ملامسة فيروس داء الكلب للأغشية المخاطية طريقة محتملة أخرى للانتقال.[ 9 ] في بعض الظروف غير العادية، مثل الإطلاق العرضي لفيروس داء الكلب كرذاذ في مختبر أو كهف يسكنه عدد كبير من الخفافيش،[ 10 ] قد يحدث انتقال عن طريق الرذاذ.
لم يتضح بعد ما إذا كانت سلالات فيروس العصبون الحركي، سواءً المتكيفة مع الفئران أو المتكيفة مع مزارع الأنسجة، تتكاثر في موقع التلقيح قبل دخولها الجهاز العصبي المركزي. في حين أظهرت العدوى العضلية التجريبية للهامستر أو الراكون الصغير بفيروس العصبون الحركي تكاثر الفيروس في خلايا العضلات المخططة قبل غزو الفيروس لمحور الخلايا العصبية الحركية عبر الوصلات العصبية العضلية،[ 11 ] [ 12 ] أظهرت العدوى العضلية للفئران بفيروس العصبون الحركي CVS-24 المتكيف مع الفئران أن الفيروس ينتقل مباشرةً إلى الجهاز العصبي المركزي دون تكاثر مسبق في موقع التلقيح.[ 13 ] بمجرد وصوله إلى نهايات المحاور العصبية غير الميالينية، ينتقل الفيروس رجعيًا إلى جسم الخلية.
تشير النتائج الحديثة إلى أن نقل الحويصلات المحورية قد يمثل استراتيجية رئيسية لحركة الفيريون لمسافات طويلة في المحاور العصبية. [ 14 ] وقد قُدِّر أن الفيروس المضخم للخلايا يهاجر داخل المحاور العصبية بمعدل 3 مم/ساعة. [ 15 ] ثم ينتشر العدوى عبر سلسلة من الخلايا العصبية المتصلة بالوصلات المشبكية. ومع ذلك، فإن الآلية الدقيقة التي تعزز الانتشار عبر المشبك لا تزال غير معروفة. بعد إصابة الدماغ، ينتشر الفيروس بشكل طرد مركزي إلى الجهاز العصبي المحيطي والجهاز العصبي اللاإرادي في العديد من الأعضاء الطرفية. [ 16 ] في المرحلة الأخيرة من دورة العدوى، يهاجر الفيروس المضخم للخلايا إلى الغدد اللعابية؛ وبعد التكاثر في الخلايا الأسينية المخاطية، يتم إطلاقه في اللعاب ويكون جاهزًا للانتقال إلى المضيف التالي. [ 17 ]
فيما يتعلق بعلم الأمراض الناجم عن فيروس داء الكلب، فقد تم اقتراح موت الخلايا المبرمج كآلية مسببة للأمراض محتملة في نماذج داء الكلب التجريبية للفئران المصابة بسلالة ثابتة من الفيروس المضخم للخلايا.[ 18 ] قد تكون الآلية المسببة للأمراض التي قد تساهم في الخلل العميق في الجهاز العصبي المركزي المميز لداء الكلب هي ضعف الوظيفة العصبية. وقد ثبت أن التعبير الجيني ينخفض بشكل ملحوظ في الخلايا العصبية المصابة بالفيروس المضخم للخلايا، مما يؤدي إلى قمع عام لتخليق البروتين،[ 19 ] وأظهرت العديد من الدراسات ضعف انتقال النبضات العصبية بعد الإصابة بالفيروس المضخم للخلايا. أظهر جيانج أن ارتباط مضاد مستقبلات الأستيل كولين بمتجانسات دماغ الفئران المصابة قد انخفض مقارنةً بالضوابط.[ 20 ] كما لوحظ ضعف إطلاق وارتباط السيروتونين، وهو ناقل عصبي يشارك في التحكم في دورة النوم وإدراك الألم والسلوك، في دماغ الفئران المصابة بالفيروس المضخم للخلايا. [ 21 ]، [ 22 ] بالإضافة إلى تأثيرها على النقل العصبي، قد تؤثر عدوى البطين الأيمن أيضًا على قنوات الأيونات. تُظهر خلايا ورم الخلايا العصبية لدى الفئران المصابة انخفاضًا في التعبير الوظيفي لقنوات الصوديوم ذات البوابات الجهدية، مما قد يمنع جهود الفعل ويؤدي في النهاية إلى ضعف وظيفي. [ 23 ]
بالإضافة إلى غياب الآفات المرضية الخطيرة في الجهاز العصبي المركزي، لا تُثير معظم حالات داء الكلب لدى البشر استجابة مناعية بعد 7 إلى 10 أيام من ظهور العلامات السريرية. وتدعم هذه الاختلافات العميقة بين آلية تطور داء الكلب وآليات تطور معظم عدوى الجهاز العصبي المركزي الفيروسية أو البكتيرية الأخرى حقيقة أن تثبيط المناعة إما غير فعال أو ضار بنتائج داء الكلب.[ 24 ] ويُعدّ انخفاض مستوى الاستجابة المناعية المُلاحظ غالبًا لدى ضحايا داء الكلب أمرًا مُحيّرًا لأنه لا يُمكن تفسيره بضعف مناعة مستضدات الفيروس اللمفاوي. في الواقع، يُعدّ بروتين الفيروس اللمفاوي G وبروتين النوكليوكابسيد مستضدات قوية للخلايا البائية والتائية عند إعطائهما عن طريق الحقن. [ 25 ] قد يكون التفسير المحتمل لانخفاض درجة الاستجابة المناعية ضد الفيروس المضخم للخلايا لدى البشر أو الحيوانات المصابة بداء الكلب هو أن عدوى الفيروس المضخم للخلايا في الجهاز العصبي المركزي تسبب تثبيط المناعة، [ 26 ] وقد تم اقتراح أن الفيروس المضخم للخلايا يستخدم استراتيجية تخريبية تتضمن منع موت الخلايا المبرمج وتدمير الخلايا التائية الغازية. [ 27 ]
تختلف سلالات الفيروس الغدي اللمفاوي المضعفة، المُكيّفة مع الخلايا غير العصبية، اختلافًا كبيرًا عن سلالات الفيروس الغدي اللمفاوي الممرض من حيث قدرتها على غزو الجهاز العصبي المركزي من مواقع محيطية. في هذا الصدد، تفتقر سلالات الفيروس الغدي اللمفاوي المتكيّفة مع مزارع الأنسجة إلى القدرة على غزو الجهاز العصبي المركزي من مواقع محيطية، أو تمتلك قدرة محدودة على ذلك، بينما سلالات الفيروس الغدي اللمفاوي المتكيّفة مع الفئران، مثل CVS-24، شديدة الغزو.[ 28 ] تشمل العوامل الرئيسية المُشاركة في غزو الفيروس الغدي العصبي امتصاص الفيروس، ونقله عبر المحور العصبي، وانتشاره عبر المشابك، ومعدل تكاثره.
حتى وقت قريب، كانت معرفتنا بآلية داء الكلب محدودة، واعتمدت بشكل أساسي على الدراسات الوصفية لسلالات داء الكلب المنتشرة في الشوارع، أو على الإصابات التجريبية بسلالات مُضعَّفة مُعَدَّلة في المختبر. وقد سمح لنا تطور تقنية علم الوراثة العكسي بتحديد العناصر الفيروسية التي تُحدد النمط الظاهري المُمْرِض لداء الكلب، وفهم الآليات المُشاركة في داء الكلب بشكل أفضل.
تحديد العناصر الفيروسية التي تتحكم في اكتساب فيروس داء الكلب وانتشاره وتكاثره
- العناصر الفيروسية المشاركة في التقاط الفيروسات
تبدأ عدوى الفيروس المضخم للخلايا بربط الفيروس بمستقبل خلوي مفترض. وعلى الرغم من اقتراح العديد من جزيئات سطح الغشاء كمستقبلات للفيروس المضخم للخلايا، بما في ذلك مستقبل الأستيل كولين النيكوتيني،[ 29 ] وجزيء التصاق الخلايا العصبية[ 30 ] ومستقبلات النيوروتروفين منخفضة الألفة p75 NTR،[ 31 ] إلا أنه لا يزال من غير الواضح ما إذا كانت هذه الجزيئات تلعب دورًا في دورة حياة فيروس داء الكلب. وفي هذا السياق، فقد ثبت مؤخرًا أن تفاعل RV G-p75 NTR غير مطلوب لإصابة الخلايا العصبية الأولية بالفيروس المضخم للخلايا.[ 32 ] وبعد ربط المستقبل، يتم استيعاب الفيروس المضخم للخلايا عن طريق البلعمة الخلوية بالامتزاز أو بوساطة المستقبل.[ 33 ] ثم تحفز بيئة الرقم الهيدروجيني المنخفضة داخل الحيز الداخلي تغيرات تكوينية في RV G تؤدي إلى اندماج الغشاء الفيروسي مع الغشاء الداخلي، وبالتالي إطلاق RNP في السيتوبلازم. [ 34 ] بالنسبة للفيروسات، يلعب RV G دورًا حاسمًا في امتصاص الفيروس، ويعود ذلك على الأرجح إلى تفاعلاته مع مستقبلات خلوية مُفترضة تُسهّل الامتصاص السريع. في هذا الصدد، ثبت أن مسببات الأمراض لسلالات RV المُتكيّفة مع زراعة الأنسجة (مثل ERA وHEP وCVS-11) ترتبط بوجود مُحدد يقع في الموقع المستضدي الثالث لبروتين G. [ 35 ] أدت طفرة Arg → Gln في الموضع 333 في هذا الموقع المستضدي لبروتين ERA G إلى تأخير سبعة أضعاف في استيعاب مُتغيِّر RV Gln333 مُقارنةً بالمُتغيِّر البري. ارتبطت طفرة Asn194→Lys194 في RV G، والتي تفسر إعادة ظهور النمط الظاهري الممرض، بانخفاض كبير في وقت الاستيعاب. [ 36 ] وعلاوة على ذلك، أظهرت التجارب التي أجريت على الفيروسات الرئوية الكيميرية أن الوقت المطلوب لاستيعاب فيروسات RV قد زاد بشكل كبير وانخفضت القدرة المرضية بشدة بعد استبدال جين G لسلالة SB RV شديدة الإمراض، والتي اشتُقت من استنساخ cDNA لسلالة RV-18 المرتبطة بالخفافيش المشتقة من الفضة، [ 37 ] مع سلالة SN شديدة الضعف، والتي تم عزلها من استنساخ cDNA لسلالة لقاح SAD B19 RV. [ 38 ] تدعم هذه البيانات مجتمعة فكرة أن حركية امتصاص الفيروس، وهي وظيفة RV G، هي عامل رئيسي في تحديد قدرة RV المرضية.
- العناصر الفيروسية المشاركة في انتشار وانتقال الفيروسات
من الخصائص الفريدة لفيروس داء الكلب قدرته على الانتشار من خلية إلى أخرى. تشير الملاحظة إلى أن متغير Gln333 ERA يفقد نشاط اندماج الخلايا المعتمد على الرقم الهيدروجيني في المختبر [ 39 ] ويظهر قدرة منخفضة للغاية على الانتشار من خلية إلى أخرى [ 40 ] إلى أن RV G يلعب أيضًا دورًا رئيسيًا في انتشار الخلايا ومن ثم انتقال الفيروس، ومن المحتمل من خلال نشاطه الاندماجي. ويدعم هذا الاحتمال أيضًا من خلال اكتشاف أن معدل انتشار SPBNGAK الممرض العائد لـ RV أعلى بمرتين تقريبًا من المعدل المحدد لمتغير SPBNGA غير الممرض. ومن المثير للاهتمام أن طفرة Asn 194 → Lys 194 في G SPBNGAK تسببت في تحول في عتبة الرقم الهيدروجيني لاندماج الغشاء إلى درجة حموضة أعلى، مما يدعم الفرضية القائلة بأن عتبة الرقم الهيدروجيني الأعلى لاندماج الغشاء مرتبطة بزيادة انتشار الفيروس. [ 41 ]
أظهرت دراسات المؤشرات عبر العصبونات لعدوى الفيروس المضخم للخلايا في الفئران [ 42 ] وقرود الريسوس [ 43 ] أن فيروس داء الكلب يهاجر حصريًا في اتجاه رجعي في المحاور العصبية. وعلى الرغم من أن العديد من بروتينات الفيروس المضخم للخلايا تشارك في آليات النقل العصبية، يبدو أن الفيروس المضخم للخلايا G يلعب دورًا رئيسيًا في انتشار عدوى الفيروس المضخم للخلايا عبر العصبونات. على سبيل المثال، في حين أن العدوى الطرفية بفيروس فقر الدم المعدي الخيلي (EIAV) المزيفة بـ RV G تؤدي إلى انتقال الفيروس إلى الحبل الشوكي، فإن نفس الفيروس المضخم للخلايا EIAV المزيفة بفيروس التهاب الفم الحويصلي G فشل في دخول الجهاز العصبي. [ 44 ] وعلاوة على ذلك، وجد أن الانتشار الفيروسي للطفرة ERA G Arg 333 → Gln 333 في الجهاز العصبي المركزي قد انخفض بشدة مقارنة بالطفرة من النوع البري، مما يشير إلى وظيفة الفيروس المضخم للخلايا G السليم في الانتشار عبر المشابك. ومع ذلك، فإن الدليل الأكثر إقناعًا على الدور المهم لـ RV G في النقل عبر المشابك يأتي من العدوى داخل الجمجمة للفئران بفيروس RV ناقص G المعاد تركيبه، والذي أظهر أن العدوى ظلت محصورة في الخلايا العصبية في موقع التلقيح دون أي دليل على انتشارها إلى الخلايا العصبية الثانوية. [ 45 ] ومع ذلك، فمن المرجح أنه بالإضافة إلى RV G، يلعب RV M أيضًا دورًا في انتشار الفيروس وبالتالي في النقل عبر المشابك. وفي هذا الصدد، فقد تبين أن انتشار متغير SN-BMBG RV الكيمري، الذي يحتوي على كل من M و G من SB شديد الإمراض، كان أعلى بكثير من انتشار متغير SN-BG أو SN-BM الكيمري، والذي يحتوي على G و M من SB، على التوالي، مما يشير إلى أن التفاعل الأمثل لـ M مع G قد يلعب دورًا مهمًا في انتشار الفيروس من خلية إلى خلية. [ 46 ] نظرًا لأن RV M يدعم تبرعم الفيروس، [ 47 ] فمن المرجح أن الانتشار الأكثر كفاءة لمتغير RV SN-BMBG الكيمري يرجع إلى تبرعم الفيروس الأمثل في الغشاء ما بعد المشبكي.
أظهرت الدراسات الحديثة أن التفاعل بين RV P وسلسلة الداينين الخفيفة يربط RNP في RV بنظام نقل الخلايا المضيفة، مما يسهل النقل المحوري الرجعي للفيروس. [ 48 ]، [ 49 ] ومع ذلك، أظهرت العدوى الطرفية للفئران البالغة أن حذف مجال ربط LC8 في RV P لا يمنع دخول الفيروس إلى الجهاز العصبي المركزي، مما يشير إلى أن بروتين RV لا يشارك بشكل مباشر في الانتشار المحوري الرجعي لـ RV. [ 50 ]
- العناصر الفيروسية التي تتحكم في تكاثر الفيروس
على عكس العديد من الفيروسات الأخرى، مثل فيروس الإنفلونزا، فإن مسببات الأمراض الفيروسية الفيروسية تتناسب عكسيًا مع معدل تخليق الحمض النووي الريبوزي الفيروسي وإنتاج الجسيمات الفيروسية المعدية. تشير مقارنة مستويات الحمض النووي الريبوزي المرسال الفيروسي والحمض النووي الريبوزي الجينومي التي تنتجها فيروسات هجينة مختلفة إلى أن نسخ الحمض النووي الريبوزي الفيروسي وتضاعفه تنظمه عوامل متعددة، بما في ذلك الفيروس الريبوزي M، الذي تم تحديده كعامل تفاعل يتوسط التحول من المستويات العالية الأولية لتخليق الحمض النووي الريبوزي المرسال إلى تخليق الحمض النووي الريبوزي الجينومي.[ 51 ] علاوة على ذلك، فإن الفيروس M من جميع فيروسات الربدو قادر على إيقاف التعبير الجيني الفيروسي عن طريق الارتباط بـ RNP، مما يؤدي إلى تكوين بنية كثيفة للغاية تشبه العمود الفقري غير قادرة على دعم تخليق الحمض النووي الريبوزي.
لتحديد عناصر فيروسية أخرى تتحكم في الإمراضية من خلال تنظيم تكاثرها، استُبدلت تسلسلات الطرفية 5' لسلالة SB شديدة الإمراض تدريجيًا بتسلسلات من سلالة لقاح SN شديدة الإضعاف، مما أدى إلى إنتاج فيروسات مُعاد تركيبها SB2 (التسلسل الطرفي [TS] + L)، وSB3 (TS + L + الجين الزائف [Ψ])، وSB4 (TS + L + Ψ + G)، وSB5 (TS + L + Ψ + G + M). أدت العدوى العضلية بفيروسي SB وSN الأصليين والفيروسات الخيمرية الكيمرية SB2 وSB3 وSB4 وSB5 إلى أعلى معدلات وفيات لدى الفئران المصابة بـ SB، بينما لم تُسجل أي حالات مرضية أو وفيات لدى الفئران المصابة بـ SN. أدى استبدال TS وL وSB بالعناصر المقابلة من SN إلى انخفاض متواضع في معدلات الإصابة والوفيات، كما أدى تبادل G أو G بالإضافة إلى M إلى تقليل أو إلغاء مسببات الأمراض الفيروسية بشكل كبير.
أظهر التوصيف الظاهري لهذه الفيروسات الفيروسية البرية والكيمرية في زراعة الأنسجة أن مسببات الأمراض لفيروس معين تتناسب عكسيًا مع قدرته على التكاثر في الخلايا العصبية. على الرغم من أن SB تضاعف بمستويات أقل بنحو 1000 ضعف من SN، وأن استبدال TS وL وSB بمستويات SN لم يكن له تأثير يُذكر على حركية نمو الفيروس، إلا أن الاستبدال الإضافي لجينات G أو G زائد M في SB بجينات SN المقابلة أدى إلى زيادة لوغاريتمية واحدة في إنتاج الفيروس، مما يشير إلى أن حركية تضاعف الحمض النووي الريبي الفيروسي، وكذلك إنتاج الجسيمات الفيروسية، يتحكم فيها إلى حد كبير بروتين RV G. ويدعم هذا الاستنتاج البيانات المستمدة من متغيرات RV G التي تختلف بحمض أميني واحد في بروتينات G الخاصة بها. أنتج متغير فيروس داء الكلب الممرض SPBNGAK 194 عيارًا فيروسيًا في خلايا NA أقل بمقدار 1 لوغاريتم من ذلك الناتج عن المتغير غير الممرض SPBNGAN 194، وأظهر تحليل تفاعل البوليميراز المتسلسل في الوقت الفعلي أن معدلات نسخ الحمض النووي الريبي الفيروسي وتكاثره في خلايا NA المصابة بـ SPBNGAK كانت أعلى بمقدار 5 و10 أضعاف من خلايا NA المصابة بـ SPBNGAK.[ 52 ] تم توفير المزيد من الأدلة على وجود علاقة عكسية بين الإمراضية ومعدل تخليق الحمض النووي الريبي الفيروسي وإنتاج الجسيمات الفيروسية من خلال الفئران المصابة بفيروسات معاد التركيب الكيمري حيث تم استبدال جينات G وM من سلالة SN المضعفة بجينات سلالة SB شديدة الإمراض. كشفت هذه التجارب عن زيادة كبيرة في الإمراضية لسلالة SN الأصلية التي تحمل RV G على سلالة SB المسببة للأمراض. زادت الإمراضية بشكل أكبر عندما تم إدخال كل من G وM من SB إلى SN.
ارتبط استبدال G أو M أو كليهما في SN بالجينات المقابلة من SB بانخفاض كبير في معدل إنتاج الجسيمات الفيروسية وكذلك معدل تخليق الحمض النووي الريبي الفيروسي. تشير هذه البيانات إلى أن كلاً من G و M يلعبان أدوارًا مهمة في التسبب في RV من خلال تنظيم التكاثر الفيروسي. إن النتيجة التي مفادها أن استبدال G أو G زائد M في SN مع G أو G زائد M من SB يؤدي إلى انخفاض متوسط إلى قوي في نسخ وتضاعف الحمض النووي الريبي الفيروسي، على التوالي، بينما يؤدي استبدال M وحده في SN مع M من SB إلى زيادة كبيرة في نسخ وتضاعف الحمض النووي الريبي الفيروسي، يشير إلى أن RV G له أيضًا وظيفة تنظيمية مهمة في نسخ/تضاعف الحمض النووي الريبي الفيروسي إما بمفرده أو من خلال التفاعل مع بروتين M. الآلية التي يتحكم بها جين RV G في تخليق الحمض النووي الريبي الفيروسي غير معروفة. تم تحديد تسلسلات نيوكليوتيدات معينة داخل جينات RV G، مثل تلك التي تتضمن الكودونات الخاصة بـ Arg333 و Lys 194، كأهداف للـ miRNAs الخلوية. لقد ثبت أن التعرف على الهدف بواسطة miRNAs الخلوية يمكن أن يؤدي إلى تنظيم إيجابي أو سلبي لتكاثر الفيروس. [ 53 ] تؤدي الاستبدالات Arg 333 → Glu 333 أو Lys 194 → Ser 194 داخل تسلسل جين RV G إلى إلغاء تسلسلات هدف miRNA، وهو ما يرتبط بدوره بزيادة كبيرة في معدل تخليق RNA الفيروسي [Faber M، جامعة توماس جيفرسون، بنسلفانيا، الولايات المتحدة الأمريكية، بيانات غير منشورة]، مما يشير إلى أن miRNAs الخلوية المضيفة تلعب أيضًا دورًا مهمًا في تنظيم تكاثر RV، كما هو موضح بالنسبة لفيروسات RNA الأخرى بما في ذلك فيروس التهاب الحويصلات وفيروس التهاب الكبد C. [ 54 ]، [ 55 ]
يبدو أن تنظيم تكاثر الفيروس يُعدّ من أهم الآليات المُشاركة في إمراضية الفيروس الغدي الرئوي. وللتهرب من الاستجابة المناعية والحفاظ على سلامة الشبكة العصبية، تستطيع سلالات الفيروس الغدي الرئوي المُمرضة، وليس السلالات المُضعَّفة، تنظيم معدل نموها. ومن المُرجَّح أن يُفيد انخفاض معدل التكاثر سلالات الفيروس الغدي الرئوي المُمرضة من خلال الحفاظ على البنية العصبية التي تستخدمها هذه الفيروسات للوصول إلى الجهاز العصبي المركزي. وهناك تفسير آخر لانخفاض معدل تكاثر الفيروس الغدي الرئوي المُمرض، وهو أنه لتجنب الكشف المُبكر من قِبل الجهاز المناعي للمُضيف، يُحافظ الفيروس على مستويات ضئيلة من التعبير عن مُستضداته.
العلاقة بين التعبير عن RV G والاستماتة والمرضية
من المعروف جيدًا أن سلالات فيروس داء الكلب في الشوارع التي تكون أكثر إمراضية بشكل ملحوظ من السلالات المتكيفة مع زراعة الأنسجة تعبر عن مستويات محدودة للغاية من G ولا تحفز موت الخلايا المبرمج حتى وقت متأخر من الدورة المعدية، مما يشير إلى أن إمراضية سلالة فيروس معينة ترتبط عكسيا بتعبير RV G والقدرة على تحفيز موت الخلايا المبرمج. [ 56 ] تم الحصول على دليل مباشر على وجود علاقة بين مستوى التعبير عن G ومدى موت الخلايا المبرمج باستخدام RV SPBNGA-GA المعاد تركيبه، والذي يحمل جينين متطابقين من G ويعبر بشكل مفرط عن RV G. [ 57 ] أظهرت الدراسات المورفولوجية للثقافات العصبية المصابة بهذا RV المعاد تركيبه أن موت الخلايا زاد بشكل ملحوظ بالتوازي مع الإفراط في التعبير عن RV G وأن موت الخلايا المبرمج هو الآلية الرئيسية المشاركة في الموت بوساطة RV G. على وجه الخصوص، فإن الانخفاض في تلطيخ F-actin بعد عدوى SPBNGA-GA يتوافق مع تحلل خيوط الأكتين الناجم عن موت الخلايا المبرمج. علاوة على ذلك، زاد عدد النوى الموجبة لـ TUNEL في الخلايا العصبية المصابة بـ SPBNGA-GA بشكل كبير مقارنةً بالخلايا العصبية غير المصابة والمصابة بـ SPBNGA. ومع ذلك، فإن الآلية التي يتوسط بها جين RV G عملية الإشارة المبرمجة للموت لا تزال غير معروفة إلى حد كبير. وقد اقترح أن التعبير عن RV G فوق عتبة معينة يعطل غشاء الخلية بشدة. ومن المرجح للغاية أن الخلايا المبرمجة للموت لا يتم التخلص منها بسرعة في الجهاز العصبي المركزي وبالتالي تخضع للنخر الثانوي. [ 58 ] من ناحية أخرى، يمكن أن تؤدي عدوى RV وخاصة الإفراط في التعبير عن بروتين RV G إلى موت الخلايا المبرمج، وهو مسار موت الخلايا المبرمج المشابه لموت الخلايا المبرمج والذي، على عكس موت الخلايا المبرمج، ينطوي على تنشيط الكاسباس 1 وبالتالي يؤدي إلى النخر. [ 59 ] ومن المرجح أن تلعب درجة النخر أو موت الخلايا المبرمج الناجم عن عدوى RV دورًا حاسمًا في تحفيز المناعة المضادة للفيروسات. في حين تحافظ الخلايا الميتة على سلامة أغشيتها ولا تحفز الاستجابة المناعية الفطرية، تصبح الخلايا الميتة نافذة وتفرز مواد مساعدة داخلية يمكنها تحفيز استجابة مناعية فطرية قوية. [ 60 ]
بما أن مستوى موت الخلايا المبرمج/النخر يرتبط باستمناع الفيروس الغدي، فقد أُشير إلى أن التأثير المحفز للمناعة للخلايا الميتة/النخرية يُسهم على الأرجح في توليد استجابة مناعية وقائية. لذلك، يُرجح أن يكون تنظيم التعبير عن جين الفيروس الغدي عاملاً مهماً في التسبب بداء الكلب، إذ يُتيح وسيلةً لبقاء وانتشار متغيرات الفيروس الغدي المُمرضة في الجهاز العصبي دون التسبب في تلف عصبي واضح، وإثارة استجابة مناعية وقائية تمنع العدوى.
قد يُنظَّم التعبير عن RV G على مستوى تخليق الحمض النووي الريبي (RNA)، أو مستوى ما بعد الترجمة، أو كليهما. وقد تبيَّن أن مستويات RV G المُعبَّر عنها بواسطة مُتغيِّرات RV الكيميرية المُختلفة تنعكس في مُعدل تخليق الحمض النووي الريبي الفيروسي، مما يُشير إلى أن التنظيم التفاضلي لتعبير RV G بواسطة هذه المُتغيِّرات ينتج عن اختلافات في مُعدل نسخ mRNA الفيروسي. وكما هو الحال مع مُعدلات نسخ RNA الفيروسي، فإن كمية RV G المُعبَّر عنها بواسطة هذه المُتغيِّرات ترتبط عكسيًا بمُمْرِضية الفيروس. من ناحية أخرى، أدت إصابة المُستنبتات العصبية الأولية بمُتغيِّر RV الأقل إمراضًا CVS-B2c إلى مستويات أعلى بأربعة أضعاف من البروتين G مُقارنةً بالإصابة بمُتغيِّر CVS-N2c شديد الإمراض، على الرغم من تخليق مستويات مُماثلة من G mRNA في كلتا الإصابتين. أظهرت تجارب مطاردة النبض أن مستويات البروتين G الأعلى في الخلايا العصبية المُصابة بـ CVS-B2c كانت إلى حد كبير نتيجةً لمعدل أقل من تحلل البروتين G في CVS-B2c مُقارنةً ببروتين G في CVS-N2c. ومع ذلك، فإن الآلية التي تؤدي إلى التحلل البروتيني السريع لبروتين CVS-N2c G لا تزال بحاجة إلى توضيح.
الأعراض داء الكلب
تتراوح فترة حضانة داء الكلب بين 30 و90 يومًا في المتوسط. في حالة العدوى الشديدة من خلال جروح كبيرة في الرأس والوجه، يمكن اختصارها إلى 12 يومًا. وفي حالات نادرة، قد تستمر فترة الحضانة لمدة عام أو أكثر.
هناك تغيير متسلسل صارم لثلاث فترات من المرض: البادرة، والإثارة، والشلل.
تبدأ الفترة المبكرة بظهور ألم مؤلم أو شد في موقع اللدغة، بالإضافة إلى ألم على طول الأعصاب. في منطقة الندبة، قد يكون هناك إحساس بالحرقان والحكة، وأحيانًا احمرار وتورم. يعاني المريض من توعك عام، وصداع، وغثيان. يُلاحظ القيء، وارتفاع في درجة حرارة الجسم إلى 37.5-38 درجة مئوية، وأعراض اضطراب عقلي تدريجي: زيادة استثارة ردود الفعل، وشعور لا يمكن تفسيره بالقلق والخوف والكآبة. غالبًا ما يكون المريض مكتئبًا، ومنعزلًا، ومنسحبًا، ويرفض تناول الطعام، وينام بشكل سيئ، ويشكو من أفكار قاتمة وأحلام مخيفة. تستمر الفترة المبكرة من 2-3 أيام، وتمتد أحيانًا إلى 7 أيام. في نهاية هذه الفترة، قد تكون هناك نوبات من القلق مع صعوبات تنفسية قصيرة المدى، وشعور بضيق في الصدر، مصحوبًا بتسرع القلب وزيادة معدل التنفس.
تتميز فترة الإثارة بظهور رهاب الماء: عند محاولة الشرب، ثم عند رؤية الماء أو أي تذكير به، يعاني المريض من تشنج تشنجي في البلعوم والحنجرة، وخلاله يرمي كوب الماء بعيدًا مع صراخ، ويرمي يديه المرتعشتين إلى الأمام، ويرمي رأسه وجسمه إلى الخلف. يتم تمديد الرقبة، وتشوه كشر مؤلم الوجه، الذي يصبح مزرقًا بسبب تشنج عضلات الجهاز التنفسي. تجحظ العينان، وتعبران عن الخوف، وتتوسلان للمساعدة، وتتوسع حدقة العين، ويصبح الاستنشاق صعبًا. في ذروة النوبة، من الممكن حدوث توقف القلب والتنفس. تستمر النوبة لعدة ثوانٍ، وبعدها يبدو أن حالة المريض تتحسن. بعد ذلك، يمكن أن تحدث نوبات تشنج في عضلات الحنجرة والبلعوم حتى من حركة الهواء (رهاب الهواء) أو الضوء الساطع (رهاب الضوء) أو كلمة عالية (رهاب الصوت). تصاحب النوبات هياج نفسي حركي، يتصرف خلاله المريض بجنون. يكون الوعي غائمًا أثناء النوبة، لكنه يزول في الفترة الفاصلة بين النوبات. خلال فترة الهياج، ونتيجةً لزيادة نشاط الجهاز العصبي الودي، يعاني المرضى من زيادة حادة في إفراز اللعاب (سيلان اللعاب) مع عدم القدرة على بلع اللعاب بسبب تشنج عضلات البلعوم. يرش المريض لعابه. قد تظهر على بعض المرضى علامات التهاب السحايا وحتى داء التشنج الجبهي، وتكون التشنجات شائعة. في هذه الحالة، قد لا يتغير السائل النخاعي، ولكن قد يزداد تركيز البروتين وعدد الخلايا لدى بعض المرضى بسبب الخلايا الليمفاوية.
في حال عدم تلقي علاج مناسب، تزداد أعراض الجفاف، وتصبح ملامح الوجه أكثر حدة، وينخفض وزن الجسم. ترتفع درجة حرارة الجسم إلى مستويات عالية. من المحتمل حدوث تشنجات. تستمر مرحلة الإثارة حوالي يومين إلى ثلاثة أيام، ونادرًا ما تصل إلى أربعة إلى خمسة أيام. عادةً ما تكون النتيجة مميتة خلال إحدى النوبات. نادرًا ما ينجو المريض حتى المرحلة الثالثة من المرض.
خلال فترة الشلل، يهدأ المريض. تتوقف نوبات رهاب الماء، ويستطيع شرب الطعام وابتلاعه، ويستعيد وعيه. ومع ذلك، ورغم هذه الحالة الصحية الظاهرة، يزداد الخمول واللامبالاة والاكتئاب، وسرعان ما يظهر شلل الأطراف واضطرابات الحوض وشلل الأعصاب القحفية. ترتفع درجة حرارة الجسم إلى 42-43 درجة مئوية، وينخفض ضغط الدم، وفي نهاية اليوم الأول تحدث الوفاة نتيجة شلل مراكز القلب والأوعية الدموية والجهاز التنفسي.
يتم ملاحظة زيادة عدد كريات الدم البيضاء المتعادلة، وزيادة الهيموجلوبين، وكريات الدم الحمراء، والهيماتوكريت في الدم المحيطي.
ما الذي يزعجك؟
إستمارات
سريريًا، تُميّز الأشكال النموذجية وغير النموذجية. تشمل الأشكال غير النموذجية جميع الحالات التي لا تعاني من الإثارة أو رهاب الماء. تشمل الأشكال غير النموذجية: البصلية، والمخيخية، والتهاب السحايا والدماغ، وغيرها.
التشخيص داء الكلب
يتيح الكشف عن مستضد داء الكلب، والأجسام المضادة، والحمض النووي الريبوزي الفيروسي، أو عزل الفيروس، تشخيص داء الكلب. ونظرًا لاحتمالية سلبية أي اختبار فردي لدى مريض مصاب بداء الكلب، فإن أخذ عينات مصل متسلسلة للكشف عن الأجسام المضادة لداء الكلب، وعينات لعاب لزراعة الفيروس، وخزعة جلدية لاختبار المناعة الفلورية المباشرة للمستضد الفيروسي، يُعد ضروريًا في بعض الأحيان، خاصةً عند الاشتباه الشديد بالإصابة بداء الكلب.
من أسرع طرق تشخيص داء الكلب قبل الوفاة لدى البشر إجراء اختبار المناعة الفلورية المباشر على خزعة جلدية من مؤخرة العنق للكشف عن مستضد داء الكلب. يُعد اختبار المناعة الفلورية المباشر الطريقة الأكثر حساسيةً ودقةً للكشف عن مستضد داء الكلب في الجلد والأنسجة الطازجة الأخرى (مثل خزعة الدماغ)، مع أن النتائج قد تكون سلبيةً أحيانًا في المراحل المبكرة من المرض. في حال عدم توفر أنسجة طازجة، قد يزيد الهضم الأنزيمي للأنسجة الثابتة من تفاعلية اختبار المناعة الفلورية؛ ومع ذلك، قد تكون الحساسية منخفضةً بشكل غير مقبول.
يمكن أيضًا تشخيص المرض بعزل الفيروس من اللعاب بعد تلقيح خلايا الورم الأرومي العصبي أو قوارض المختبر؛ وعادةً ما يكون هذا الاختبار أكثر فعالية خلال أول أسبوعين إلى ثلاثة أسابيع من المرض. كما يُعدّ الكشف عن الأجسام المضادة المُحيِّدة لفيروس داء الكلب، والتي تُجرى عادةً باستخدام اختبار تثبيط التركيز الفلوري السريع (RFFIT)، في مصل الأفراد غير المُطعَّمين تشخيصيًا أيضًا. يؤكد وجود الأجسام المضادة في السائل النخاعي التشخيص، ولكنها قد تظهر بعد يومين إلى ثلاثة أيام من ظهور الأجسام المضادة في المصل، وبالتالي قد تكون أقل فائدة في المراحل المبكرة من المرض. في حين أن الاستجابة المصلية التي تلي التطعيم لا يمكن تمييزها عمومًا عن الاستجابة المصلية التي يُحدثها المرض، إلا أن التطعيم لا يُنتج عادةً أجسامًا مضادة للسائل النخاعي.
لم تُوثَّق سوى سبع حالات شفاء من داء الكلب خلال السنوات الخمس والعشرين الماضية. ورغم عدم عزل فيروس داء الكلب من أيٍّ من المرضى، إلا أن ارتفاع مستويات الأجسام المضادة المُحيِّدة لداء الكلب في عينات المصل، ووجودها في السائل الدماغي الشوكي، دعما التشخيص بقوة.
ما الذي يجب فحصه؟
ما هي الاختبارات المطلوبة؟
تشخيص متباين
عادةً ما يُشخَّص داء الكلب البشري بناءً على البيانات الوبائية والسريرية، ويُؤكَّد في المختبر. يكون التشخيص واضحًا ومباشرًا في حال وجود تاريخ من عضات الحيوانات وظهور جميع الأعراض والعلامات. أما في الحالات الأقل شيوعًا، فيلزم إجراء تقييم دقيق وسريع للخصائص الوبائية والسريرية للحالات الأقل شيوعًا قبل إجراء فحوصات مخبرية محددة. يجب سؤال أي مريض يُعاني من علامات أو أعراض عصبية أو التهاب دماغي غير مُفسَّر عن احتمالية تعرضه للحيوانات في المناطق الموبوءة بداء الكلب، سواء داخل بلد إقامته أو خارجه. ولعل عدم الاشتباه في داء الكلب في العديد من الوفيات البشرية الأخيرة في الولايات المتحدة يعود إلى عدم وجود تاريخ دقيق للتعرض.
في بداية المرض، يمكن أن يُحاكي داء الكلب العديد من الأمراض المعدية وغير المعدية. وتشبه العديد من التهابات الدماغ الأخرى، مثل تلك التي تُسببها فيروسات الهربس والفيروسات المنقولة بالمفصليات، داء الكلب. كما يمكن لأمراض معدية أخرى أن تُحاكي داء الكلب، مثل الكزاز والملاريا الدماغية وداء الريكتسيات وحمى التيفوئيد. ومن الأمراض المعدية الشللية التي يُمكن الخلط بينها وبين داء الكلب: شلل الأطفال، والتسمم الغذائي، والتهاب الدماغ الناتج عن فيروس الهربس القردي ب.
تشمل الأمراض غير المعدية التي قد يُخلط بينها وبين داء الكلب عددًا من المتلازمات العصبية، وخاصةً اعتلال الأعصاب الالتهابي الحاد (متلازمة غيلان باريه)، بالإضافة إلى التهاب الدماغ والنخاع التحسسي التالي للتطعيم ضد داء الكلب في الأنسجة العصبية، والتسمم أو التسمم الدوائي، وأعراض الانسحاب الكحولي، والبورفيريا الحادة، وهستيريا داء الكلب. قد يُخلط بين متلازمة غيلان باريه وداء الكلب الشللي، والعكس صحيح.
من الاتصال؟
علاج او معاملة داء الكلب
لم يُطوَّر علاجٌ لداء الكلب. ولا يُجدي إعطاء جرعات كبيرة من الغلوبولين المناعي المضاد لداء الكلب والإنترفيرون الكريات البيضاء نفعًا. ويُقدَّم علاجٌ عرضيٌّ لتخفيف معاناة المريض. ولهذا الغرض، يُوضَع المريض في جناحٍ أو صندوقٍ منفصل، ويُوفَّر له نظامٌ وقائيٌّ يحدُّ من تأثير البيئة الخارجية (مثل تقليل الضوضاء، والإضاءة الساطعة، وتدفق الهواء). وللحدِّ من استثارة الجهاز العصبي المركزي، تُوصف له حبوبٌ منومة، ومضاداتٌ للاختلاج، ومسكناتٌ للألم. ويُعاد توازن الماء في الجسم إلى طبيعته.
في المرحلة الشللية، تُوصف أدوية تُحفّز نشاط الجهازين القلبي الوعائي والتنفسي. يُنصح باستخدام الأكسجين عالي الضغط، وخفض حرارة الدماغ، والتنفس الميكانيكي المُتحكّم به، مع العلاج الكامل للمريض. مع ذلك، فإن جميع طرق العلاج غير فعّالة عمليًا. في أفضل الأحوال، يُمكن إطالة عمر المريض لعدة أشهر. تُحدّد شدة الضرر الذي يُصيب جذع الدماغ، مع تدمير المراكز الحيوية، النتيجة غير المُرضية مُسبقًا.
الوقاية
أدى تطوير أول لقاح لداء الكلب من قبل باستور عام 1885 إلى بداية عصر من السيطرة الفعالة على داء الكلب. واليوم، وعلى الرغم من معدل الوفيات بين البشر بسبب داء الكلب والذي يقارب 100%، إلا أنه يمكن الوقاية من المرض تمامًا من خلال التطعيم قبل التعرض أو بعده. وبينما بدأ باستور وزملاؤه تطعيم الكلاب الخاصة في باريس، تم إجراء أول تطعيم جماعي للكلاب في أوائل عشرينيات القرن العشرين في اليابان، مما يمثل أول برنامج وطني رئيسي لمكافحة داء الكلب. ومنذ ذلك الحين، أثبت التطعيم الفموي للحيوانات البرية، الذي طُوّر لأول مرة في سبعينيات القرن العشرين، فعاليته في السيطرة على المرض لدى العوائل الأرضية الرئيسية مثل الثعالب والراكون والظربان.[ 68 ] سيؤدي التطعيم المستمر ضد داء الكلب لحيوانات الخزانات بمعدلات تغطية 70% أو أعلى في النهاية إلى القضاء على فيروس داء الكلب من الأنواع الخزانات ومنع انتشار الفيروس إلى العوائل العرضية.[ 69 ]
تشير البيانات التطورية إلى أن فيروسات الليسا أصابت الخفافيش قبل فترة طويلة من إصابتها للثدييات الأرضية، ولا تزال معظم فيروسات الليسا، بما في ذلك فيروس داء الكلب، منتشرة بين أنواع مختلفة من الخفافيش حول العالم.[ 70 ] ومع ذلك، لا تزال الطرق الفعالة لمنع انتقال فيروس داء الكلب بين الخفافيش بعيدة المنال، مما يستبعد إمكانية القضاء التام على داء الكلب في الوقت الحالي. ومع ذلك، حتى بعد التعرض لفيروس داء الكلب من خلال لدغة حيوان ثديي مصاب بداء الكلب، يمكن للوقاية الآمنة والفعالة بعد التعرض (بما في ذلك تنظيف الجروح، والغلوبيولين المناعي لداء الكلب، والتطعيم ضد داء الكلب) أن تحمي البشر من عدوى داء الكلب إذا تم تقديم العلاج على الفور ووفقًا لتوصيات منظمة الصحة العالمية.
هاتان الطريقتان للوقاية من الوفيات البشرية - إحداهما تعتمد على تطعيم الأشخاص المعرضين للفيروس والأخرى على تطعيم عدد كافٍ من الكلاب لكسر حلقة انتقال العدوى من المصدر - تُشكلان حجر الأساس لنهج "الصحة الواحدة" للوقاية من داء الكلب لدى الكلاب ومكافحته. وقد اعتُبرت هاتان الطريقتان المختلفتان للوقاية من الوفيات البشرية بديلين منفصلين: الاستراتيجية أ، القائمة على توفير الوقاية بعد التعرض للأشخاص، والاستراتيجية ب، القائمة على تطعيم الكلاب؛ أو كمكونات لاستراتيجية أ + ب مُدمجة عند تحليل التكاليف المحتملة للاستراتيجيات البديلة.[ 71 ]
لقد حققت دول مثل تايلاند نجاحًا هائلاً في منع الوفيات البشرية من خلال استخدام الوقاية بعد التعرض، ولكنها وجدت أيضًا طلبًا متزايدًا وتكاليف مصاحبة مرتبطة باستخدام الوقاية بعد التعرض وحدها. [ 72 ] على سبيل المثال، بالمقارنة مع الوضع في عام 1991، احتاج أربعة أضعاف عدد الأشخاص (أكثر من 400000) إلى الوقاية بعد التعرض في عام 2003. تُظهر البيانات الحديثة أن جمهورية الصين الشعبية، التي تُلقح 15 مليون شخص سنويًا بعد التعرض المحتمل لداء الكلب، تنفق حوالي 650 مليون دولار أمريكي سنويًا على الوقاية بعد التعرض وحدها. [ 73 ]
هناك نهج أكثر استدامة يتمثل في منع انتشار العدوى من المصدر، أي في الحيوانات، مع زيادة فرص الحصول على العلاج الوقائي بعد التعرض للمرضى البشر المعرضين للفيروس عند الحاجة. في حال توفرت الإرادة السياسية والتمويل الكافي للسيطرة على داء الكلب لدى الكلاب، يمكن القضاء على الوفيات، وقد تم ذلك بالفعل. وقد أدى الاستخدام الواسع النطاق لتطعيم الكلاب إلى القضاء على داء الكلب لدى الكلاب في العديد من البلدان، بما في ذلك ماليزيا عام ١٩٥٤، [ ٧٤ ] واليابان عام ١٩٥٦، وتايوان عام ١٩٦١، وسنغافورة، وعلى وجه الخصوص في جميع أنحاء أوروبا الغربية (راجع روبريخت وآخرون، وكينغ وآخرون، وغونغال ورايت). [ ٧٥ ]
Использованная литература


 [
[