فيروس نقص المناعة البشرية (فيروس نقص المناعة البشرية)
آخر مراجعة: 23.04.2024

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
تم عزل متلازمة العوز المناعي المكتسب كمرض خاص في عام 1981 في الولايات المتحدة ، عندما كانت الأمراض الشديدة في عدد من الشباب تسببها الكائنات الدقيقة التي تكون غير ممرضة أو ممرضة قليلاً بالنسبة للأشخاص الأصحاء. كشفت دراسة الحالة المناعية للمرضى عن انخفاض حاد في عدد الخلايا الليمفاوية بشكل عام ومساعدي تي بشكل خاص. هذه الحالة تسمى الإيدز (متلازمة نقص المناعة المكتسبة الإنجليزية - متلازمة نقص المناعة المكتسب أو الإيدز). وأشارت طريقة العدوى (الاتصال الجنسي ، من خلال الدم ومستحضراته) إلى الطبيعة المعدية للمرض.
اكتشف العامل المسبب لمرض الإيدز في عام 1983 بشكل مستقل الفرنسي L. مونتانييه، الذي وصفه بأنه LAV Lymphoadenopathy أسوشيتد الفيروسات)، منذ أن وجدت أنه في العقد اللمفية المريض. والأميركي ر. جالو ، الذي أطلق عليه الفيروس HTLV-III (بالإنجليزية: T-lymphotropic Virus III): عُثر سابقاً على فيروسات ليمفاوية (1) و (II).
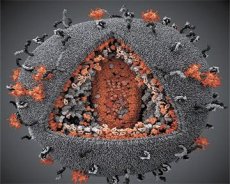
أظهرت مقارنة خصائص فيروسات LAV و HTLV-III هويتها ، لذلك في عام 1986 تم استدعاء الفيروس HIV (فيروس نقص المناعة البشري ، أو فيروس نقص المناعة البشرية) من أجل تجنب الارتباك. فيروس نقص المناعة البشرية هو كروي ، وقطره 110 نانومتر. يحتوي غلاف الفيروس على شكل متعدد الوجوه مكون من 12 خماسية و 20 سداسي. يقع جزيء البروتين glycosylated gpl20 في المركز وزوايا كل مسدس (العدد 120 يعني الوزن الجزيئي للبروتين في kilodaltons). يوجد ما مجموعه 72 جزيء gpl20 على سطح الفيريون ، يرتبط كل منها بروتين intembembrane gp41. هذه البروتينات جنبا إلى جنب مع طبقة الدهون المزدوجة تشكل supercapsid (غشاء) من virion.
وتتكون البروتينات gpl20 و gp41 نتيجة لبروتياز الخلية قطع البروتين السلائف Env. ويشكل البروتين gp41 "مسمار" العمود الفقري ، حيث يتم ربطه من خلال المجال السيتوبلازمي مع بروتين المصفوفة p17MA مباشرة تحت الغشاء. وتشكل الجزيئات p17 ، التي تتفاعل مع نضج الفيريون ، عظام الإيكوسوترون الموجودة في الغلاف.
في الجزء المركزي من الفيريون ، يشكل بروتين P24 غلافًا مخروطيًا مخروطيًا. يرتبط الجزء الضيق من القفيصة بمشاركة بروتين pb بظرف الفيريون. داخل القفيصة ، هناك جزيئين متطابقين من الحمض النووي الريبي الجينومي الفيروسي. هم ملزمون في نهايتهم '5 إلى بروتين nucleocapsid p7NC. هذا البروتين المثير للاهتمام في أن لديها اثنين من مخلفات الأحماض الأمينية (عزر)، السيستين الغنية والذرة الحامض الاميني ويحتوي على الزنك، - ما يطلق عليه "إصبع الزنك"، كما قبض على جزيء RNA الجيني لإدراجها في virions تشكيلها. يحتوي القفيص أيضًا على ثلاثة إنزيمات. Reversase (RT) ، أو pol-complex ، يتضمن النسخ العكسي لل transcriptase ، RNA-ase H ، و DNA polymerase المعتمد على DNA. و revertase هو الحاضر باعتباره heterodimer p66 / p51. البروتيز (PR) - pI ، يبدأ ويدرك عملية النضج virion. التكامل (IN) - p31 ، أو endonuclease ، يضمن تضمين الحمض النووي الريبيزي في جينوم الخلية المضيفة. يحتوي القفيص أيضا على جزيء RNA بذرة (tRNAl "3).
يتم تحويل الجين RNA في الخلية عن طريق نسخ المنتسخة العكسية إلى جينوم DNA (DNA-provirus) يتكون من 9283 زوج نيوكليوتيد. يقتصر على اليسار واليمين من خلال ما يسمى بتكرارات نهاية طويلة ، أو LTR (تكرار المحطة الطرفية الطويلة باللغة الإنجليزية): S'-LTR - اليسار و Z'-LTR - على اليمين. يحتوي LTR على 638 زوج نيوكليوتيد.
يتكون جينوم فيروس نقص المناعة البشرية من 9 جينات ، بعضها متداخل (يحتوي على العديد من إطارات القراءة) وله بنية exonine. وهي تتحكم في تركيب 9 بروتينات تنظيمية و 6 بروتينات تنظيمية.
إن قيمة LTR للجينوم الفيروسي هي أنها تحتوي على العناصر التنظيمية التالية التي تتحكم في أدائها:
- إشارة النسخ النسبي (منطقة المروج) ؛
- إشارة لإضافة بولي- أ ؛
- إشارة التقاط
- تكامل الإشارة
- إشارة تنظيمية إيجابية (TAR لبروتين TAT) ؛
- عنصر من التنظيم السلبي (NRE لبروتين NEF) ؛
- الموقع المرفق للبذور RNA (tRNA ™ 3) لتخليق سلسلة ناقص DNA في الطرف 3 '؛ إشارة في نهاية 5 'من LTR ، الذي يعمل بمثابة التمهيدي لتوليف الحمض النووي زائد من حبلا.
بالإضافة إلى ذلك ، يحتوي LTR على عناصر تشارك في تنظيم الربط mRNA ، وتعبئة جزيئات الحمض الريبي النووي الريبي في capsid (عنصر Psi). وأخيرًا ، عند نسخ الجينوم في mRNAs طويلة ، يتم توليد إشارتين لبروتين REV ، الذي يبدل تركيب البروتين: CAR للبروتينات التنظيمية و CRS للبروتينات الهيكلية. إذا كان البروتين REV يرتبط بـ CAR ، يتم تصنيع البروتينات البنيوية ؛ إذا كان غائبا ، يتم توليفها فقط البروتينات التنظيمية.
في تنظيم جينوم الفيروس ، تلعب الجينات المنظمة التالية وبروتيناتها دورًا مهمًا بشكل خاص:
- بروتين TAT الذي يقوم بالتحكم الإيجابي في تكاثر الفيروس ويعمل من خلال موقع TAR التنظيمي ؛
- البروتينات NEV و VPU ، التي تقوم بالتحكم السلبي في الإنجاب من خلال موقع NRE ؛
- بروتين REV ، الذي يقوم بالتحكم الإيجابي السلبي. يتحكم البروتين REV في عمل الجينات والبول ، env وينفذ تنظيم سلبي من الربط.
وهكذا ، فإن تكاثر فيروس نقص المناعة البشرية يخضع لسيطرة ثلاثية - إيجابية وسلبية وإيجابية سلبية.
يحدد البروتين VIF عدوى الفيروس المركب حديثًا. وهو مرتبط ببروتين القفيصة p24 وهو موجود في الفيريون بكمية مقدارها 60 جزيء. يتم تمثيل البروتين NEF في الفيريون عن طريق عدد قليل من الجزيئات (5-10) ، وربما ترتبط بالمظروف.
البروتين VPR يمنع دورة الخلية في المرحلة G2، والمشاركة في المجمعات preintegratsionnyh النقل في نواة الخلية وينشط بعض الجينات الفيروسية والخلوية، ويزيد من كفاءة تكاثر الفيروس في وحيدات الضامة. لم يتم تأسيس موقع البروتينات VPR ، TAT ، REV ، VPU في virion.
بالإضافة إلى البروتينات الخاصة به ، قد يشتمل تركيب غشاء الفيريون على بعض البروتينات في الخلية المضيفة. تشارك البروتينات VPU و VPR في تنظيم إعادة إنتاج الفيروسات.
المتغيرات المستضدية من فيروس نقص المناعة البشرية (فيروس نقص المناعة البشرية)
فيروس نقص المناعة البشرية (فيروس نقص المناعة البشرية) هو متغير جدا. حتى من الكائن الحي لمريض واحد ، يمكن عزل سلالات الفيروس التي تختلف اختلافاً كبيراً في خصائص المستضدات. يتم تعزيز هذا التقلب من خلال التدمير المكثف لخلايا CD4 + واستجابة قوية للجسم المضاد للإصابة بفيروس نقص المناعة البشرية. يعاني المرضى القادمون من غرب إفريقيا من شكل جديد من فيروس نقص المناعة البشرية ، قريب بيولوجياً من فيروس HIV-1 ، ولكنه يختلف مناعياً عنه ، HIV-2. تماثل البنية الأساسية لجينوم هذه الفيروسات بنسبة 42٪. يحتوي DNA-provirus HIV-2 على 9671 bp ، و LTR - 854 bp. تم عزل فيروس HIV-2 في مناطق أخرى من العالم. لا توجد حصانة بين فيروس العوز المناعي البشري -1 وفيروس العوز المناعي البشري -2. من المعروف أن هناك شكلين كبيرين من فيروس HIV-1: O (Outlier) و M (Major) ، يتم تقسيم الأخير إلى 10 أنواع فرعية (AJ). في روسيا ، 8 أنواع فرعية تدور (ه).
آلية تفاعل فيروس نقص المناعة البشرية مع الخلية
بعد أن اخترق الجسم ، يهاجم الفيروس الخلايا التي تحتوي على مستقبل CD4 محدد. يحتوي هذا المستقبِل على عدد كبير من المساعدين T ، في أقل - macrophages و monocytes ، خاصةً T-helpers.
يتعرف فيروس نقص المناعة البشرية (HIV) على مستقبلات CD4 مع بروتين gpl20. عملية تفاعل فيروس نقص المناعة البشرية مع عائدات الخلية وفقا للنظام التالي: الامتزاز بوساطة المستقبلة -> نقرة يحدها -> حويصلة يحدها -> lysosome. في ذلك ، يندمج الغشاء الفيريوني مع غشاء الليزوزوم ، و nucleocapsid ، المحررة من supercapsid ، يدخل السيتوبلازم. في الطريق إلى النواة يتم تدميرها ، ويتم إطلاق الحمض النووي الريبي الجيني والمكونات الأساسية المرتبطة بها. المقبل، والناسخ العكسي يجمع على الفيريون حبلا RNA-DNA ناقص، تليها ريبونوكلياز H يدمر الحمض النووي الريبي الفيريون والبلمرة DNA الفيروسي يجمع DNA بالإضافة إلى سلسلة. في نهايات DNA-provirus ، يتم تشكيل 5'-LTR و 3'-LTR. يمكن أن يكون فيروس الحمض النووي في النواة لفترة في شكل غير نشط ، ولكن عاجلاً أم آجلاً ، يتكامل مع مساعدة من integrase في الكروموسوم للخلية المستهدفة. في ذلك ، فإن الفيروس هو في حالة غير نشطة حتى يتم تنشيط هذه الخلايا اللمفاوية التائية عن طريق المستضدات الميكروبية أو غيرها من الخلايا المناعية. ينظم تنشيط نسخ الحمض النووي الخلوي بواسطة عامل نووي خاص (NF-kB). وهو بروتين ربط DNA ويتم إنتاجه بكميات كبيرة أثناء تنشيط وانتشار الخلايا اللمفاوية التائية والحيدات. يرتبط هذا البروتين بتسلسلات محددة من الحمض النووي الخلوي وتتابعات مماثلة من LTR DNA-provirus ويحفز نسخ كل من الحمض الخلوي DNA و DNA-provirus. بتحريض النسخ من فيروس الحمض النووي ، فإنه ينتقل الفيروس من حالة غير نشطة إلى نشطة ، وبالتالي ، عدوى مستمرة ، إلى واحدة منتجة. البقاء provirus في حالة غير نشط يمكن أن تستمر لفترة طويلة جدا. يعد تنشيط الفيروس لحظة حرجة في تفاعله مع الخلية.
من اللحظة التي يدخل فيها الفيروس الخلية ، تبدأ فترة الإصابة بفيروس نقص المناعة البشرية ، وهو فيروس يمكن أن يستمر 10 سنوات أو أكثر. ومنذ بدء تشغيل الفيروس يبدأ المرض - الإيدز. وبمساعدة جيناتها التنظيمية ومنتجاتها ، يبدأ الفيروس في التكاثر بنشاط. يمكن للبروتين TAT زيادة معدل تكاثر الفيروس 1000 مرة. نسخ الفيروس معقد. وهو يشمل تشكيل كل من mRNAs كاملة الطول و subgenomic ، وربط mRNA ، والمزيد من توليف البروتينات الهيكلية والتنظيمية.
يحدث توليف البروتينات الهيكلية على النحو التالي. أولا ، يتم تصنيع سليفة البولي بروتين Pr55Gag (بروتين بكتلة 55 كيلو دالتون). أنه يحتوي على أربعة مجالات رئيسية هي: مصفوفة (MA)، قفيصة (CA)، قفيصة منواة (NC) والمؤسسة العامة للنطاق، والتي ينتج قطع Pr55Gag الفيروسي البروتيني (عليه samovyrezaetsya من السلائف بروتين آخر - الكمامة بول) تتشكل على التوالي البروتينات الهيكلية P17 و p24 و p7 و pb. إن تشكيل polyprotein Pr55Gag هو الشرط الرئيسي لتشكيل الجسيمات الفيروسية. هذا هو البروتين الذي يحدد برنامج التوليف من virion. ويشمل الخطوات النقل بالتتابع الكمامة polyprotein إلى غشاء البلازما وتفاعله مع تفاعلات البروتين البروتين في تكوين جسيمات الفيروس ومهدها لها. يتم تصنيع Pr55Gag على polyribosomes الحرة. يتم نقل جزيئات البروتين إلى الغشاء الذي ترتكز عليه بقعه الكارهة للماء. يتم لعب الدور الرئيسي في إنشاء تشكّل أصلي لبروتين Gag من قبل مجال CA. يضمن المجال NC التضمين (بمساعدة من "أصابع الزنك") من جزيئين من الحمض النووي الريبي الجينومي في تكوين الجسيمات الفيروسية الناشئة. يكون أول جزيء بوليبروتين ثنائي اللون بسبب تفاعل نطاقات المصفوفة. ثم يتم دمج dimers في مجمعات hexameric (من 6 وحدات) كنتيجة للتفاعل بين نطاقات CA و NC. وأخيرا، hexamers، وربط الأسطح الجانبية تشكل virions غير ناضجة شكل كروي، داخل والتي تحتوي على الفيروسي RNA الجيني القبض NC-المجال.
ويتم تصنيع البروتين آخر السلائف Prl60Gag بول (البروتين مع م. م 160 كيلو دالتون) نتيجة لتحويل إطار القراءة من الريبوسوم خلال الترجمة Z'-محطة من الجينات هفوة إلى المنطقة على الفور قبل ترميز البروتين المنطقة RB. يحتوي هذا البروتين البولي بروتين Gag-Pol على تسلسل غير مكتمل من بروتين Gag (أحماض أمينية من 1 إلى 423) ومتواليات Pol ، والتي تشمل PR و RT و IN domains. كما يتم تحضير جزيئات البولي بروتين Gag-Pol على بوليريفوسومات حرة ونقلها إلى غشاء البلازما. يحتوي polyprotein Prl60Gagpol على جميع مواقع التفاعلات بين الجزيئية المتأصلة في مواقع ربط الغشاء البولي بروبيلين وغشاء. ولذلك، فإن جزيئات من polyprotein الكمامة بول فتيل مع الغشاء، وجنبا إلى جنب مع تشتمل على جزيئات الكمامة تشكيل virions، مما قد يؤدي إلى تبدأ الأنزيم البروتيني والفيريون عملية النضج النشطة. HIV-1 البروتياز نشطة للغاية فقط باعتبارها ديمر، لذلك samovyrezaniya من Prl60Gag بول يتطلب dimerization من هذه الجزيئات. نضج الفيريون هو أن البروتيين النشطين المفصولين يخفضان prl60Gag-Pol و Gag55 إلى مواقع يمكن التعرف عليها. يتم تشكيل البروتينات p17 ، p24 ، p7 ، p6 ، revertase ، integrase وتجري ارتباطها في البنية الفيروسية.
يتم تصنيعه من البروتين الحياة الفطرية على الريبوسومات المرتبطة أغشية الشبكة الإندوبلازمية، الغليكوزيلاتي ومن ثم يتم قطع عليه البروتيني الخلوي لgp120 وgp41 ونقلها إلى سطح الخلية. في هذه الحالة ، يتخلل gp41 الغشاء ويربط مجالات المصفوفة لجزيء بروتين Gag المرتبط بالسطح الداخلي للغشاء. تستمر هذه العلاقة في virion الناضجة.
وبالتالي، هو تجميع جزيئات الفيروس تجميع البروتينات السلائف وجزيئات RNA ذات الصلة على الغشاء البلازمي للخلية المضيفة، وتشكيل virions ناضجة وإطلاق سراحهم من قبل في مهدها من سطح الخلية. عندما تبرعم ، تحيط الفيريون بغشاء خلوي ، تكون فيه الجزيئات gp41 و gp120 مدمجة. خلال مهدها أو ربما بعد الافراج عن نضوج الفيريون يحدث، التي يتم تنفيذها باستخدام البروتيني الفيروسي وقطع بروتين البروتينات Pr55Gag السلائف وفيروس Prl60Gag بول إلى أن تنضج البروتينات وارتباطهم إلى المجمعات هيكلية محددة. دور رائد في التشكل من الفيروس يلعب polyprotein السلائف Pr55Gag، التي تنظم وتجمع الفيريون غير ناضجة. اكتمال عملية نضوجها من قبل بروتيز فيروسية محددة.
أسباب نقص المناعة
أحد الأسباب الرئيسية لأمراض نقص المناعة في الإصابة بفيروس نقص المناعة البشرية هو الموت الجماعي لمساعدي T. يحدث ذلك بسبب الأحداث التالية. أولا، تموت بسبب موت الخلايا المبرمج خلايا T-المساعد المصابة بالفيروسات. ويعتقد أنه في مرضى الإيدز ، ترتبط تكرار الفيروسية ، موت الخلايا المبرمج وانخفاضا في عدد من المساعدين T-. ثانيا، خلايا T-القاتل تعترف وتدمير T-الخلايا المصابة بفيروس أو تحمل الجزيء كثف gpl20، وكذلك خلايا T-المساعد المصابة بالفيروسات والمصابة بالفيروسات، والتي تشكل symplasts (syncytia)، ويتألف من عدة عشرات من الخلايا (جزء من يموتون نتيجة لتكاثر الفيروسات فيهم). ويرجع ذلك إلى تدمير عدد كبير من الخلايا T-المساعد يحدث التعبير غشاء انخفاض مستقبلات في الخلايا الليمفاوية B لIL-2، والتوليف بالانزعاج من مختلف الإنترليوكينات (عوامل النمو والتفريق بين B-الخلايا الليمفاوية - IL-4 و IL-5، IL-6، وغيرها) ونتيجة لذلك يتم انتهاك وظيفة نظام T-killer. قمع نشاط مكملة وأنظمة البلعم يحدث. لا تموت البلاعم المصابة بالفيروسات وحيدة الخلية لفترة طويلة ، ولكنها غير قادرة على إزالة الفيروس من الجسم. وأخيرا، وذلك بسبب التشابه الهيكلي ومولدة مع مستقبلات gpl20 بعض الخلايا الظهارية للكائن الحي (بما في ذلك أرومة مغذية مستقبلات يتوسط انتقال زرع HIV) يتم تصنيعه antiretseptornyh الأجسام المضادة مع مجموعة واسعة من العمل. مثل هذه الأجسام المضادة يمكن أن تمنع المستقبلات الخلوية المختلفة وتعقد مسار المرض مع اضطرابات المناعة الذاتية. نتيجة الإصابة بفيروس نقص المناعة البشرية هي هزيمة جميع الأجزاء الرئيسية في الجهاز المناعي. يصبح هؤلاء المرضى العزل ضد مجموعة واسعة من الكائنات الحية الدقيقة. هذا يؤدي إلى تطوير الالتهابات الانتهازية والأمراض الورمية. بالنسبة للمرضى المصابين بعدوى فيروس العوز المناعي البشري ، تعرض ثلاثة أنواع على الأقل من السرطان لخطر متزايد: ساركوما كابوزي. السرطانات (بما في ذلك سرطان الجلد) ؛ سرطان الغدد الليمفاوية B ينجم عن تنكس خبيث في الخلايا الليمفاوية B. ومع ذلك، لديها فيروس نقص المناعة البشرية limfotsito- فحسب، بل موجه للعصب. يخرقها في الجهاز العصبي المركزي الخلايا (الخلايا النجمية) إما عن طريق الإلتقام مستقبلات بوساطة والبلعمة من الخلايا النجمية مع الابيضاض اللمفاوي المصابة بالفيروسات. عندما يتفاعل الفيروس مع الخلايا النجمية ، تتشكل أيضا symplasts ، مما يسهل انتشار الممرض من خلال القنوات بين الخلايا. في الضامة وحيدات، فإن الفيروس قد تستمر لفترة طويلة، حتى أنها بمثابة خزان وموزعيها في الجسم، والقدرة على اختراق جميع الأنسجة. الضامة المصابة لها دور كبير في هجرة فيروس نقص المناعة البشرية في الجهاز العصبي المركزي وهزيمته. في 10 ٪ من المرضى ، ترتبط متلازمات السريرية الأولية مع تلف الجهاز العصبي المركزي وتظهر باسم الخرف (العته). وهكذا، بالنسبة للأشخاص المتأثرين بفيروس نقص المناعة البشرية تتميز 3 مجموعات من الأمراض - العدوى الانتهازية والأمراض السرطانية والجهاز العصبي المركزي.
وبائيات عدوى فيروس نقص المناعة البشرية
مصدر الإصابة بفيروس نقص المناعة البشرية هو مجرد شخص - مريض أو ناقل الفيروس. تم العثور على فيروس نقص المناعة البشرية (فيروس نقص المناعة البشرية) في الدم والسائل المنوي وسوائل عنق الرحم. في الأمهات المرضعات - في حليب الثدي. تحدث العدوى جنسياً ، من خلال الدم وعقاقيرها ، وكذلك من الأم إلى الطفل قبل الولادة وأثناء الولادة وبعدها. حالات الإصابة بالفيروس من خلال الطعام والمشروبات وعضات الحشرات غير معروفة.
الإدمان على المخدرات يساهم في انتشار مرض الإيدز. يزداد معدل الإصابة بفيروس نقص المناعة البشرية كل عام. وفقا لمنظمة الصحة العالمية ، من 1980 إلى 2000 ، أصيب 58 مليون شخص بفيروس نقص المناعة البشرية. وفي عام 2000 فقط ، أصيب 5.3 ملايين شخص في العالم ، وتوفي 3 ملايين شخص بسبب الإيدز. في روسيا ، اعتبارًا من 1 يناير 2004 ، تم تسجيل 264000 شخص مصاب بفيروس نقص المناعة البشرية. نصف المصابين بفيروس نقص المناعة البشرية يموتون في غضون 11-12 سنة من العدوى. في أوائل عام 2004 ، من بين كل 100000 مواطن روسي ، عاش حوالي 180 مع تشخيص "عدوى فيروس نقص المناعة البشرية". ومن المتوقع أنه عند هذا المستوى من الإصابة ، فإن العدد الإجمالي للأشخاص المصابين بفيروس نقص المناعة البشرية في روسيا بحلول عام 2012 سيكون 2.5-3 مليون شخص. يعتمد تعقيد مكافحة فيروس نقص المناعة البشرية على عدد من الأسباب: أولاً ، لا توجد طرق فعالة لعلاجه والوقاية منه. وثانيا ، يمكن أن تتجاوز فترة الحضانة للإصابة بفيروس نقص المناعة البشرية 10 سنوات. وتعتمد مدته على لحظة تفعيل الخلايا اللمفاوية التائية وداء الحمض النووي المتواجد في كروموسومها. ليس من الواضح بعد ما إذا كان كل فيروس مصاب بالإيدز محكوم عليه بالفيروس أو من المحتمل أن يكون لديه فيروس طويل الأمد بدون مرض (وهو أمر يبدو مستبعدًا). وأخيرا ، هناك العديد من فيروسات نقص المناعة البشرية (HIV-1 ، HIV-2) ، والاختلافات المستضدية التي تمنع تشكيل الحصانة. الكشف عن فيروس نقص المناعة لدى القرود (SIV) يلقي الضوء على أصل فيروس نقص المناعة البشرية. يشبه SIO لتنظيم الجينوم HIV ، لكنه يختلف اختلافًا كبيرًا في تسلسل النوكليوتيدات. يحتل فيروس HIV-2 موضعيًا وضعًا وسيطًا بين HIV-1 و SIV ، وكان تسلسل النوكليوتيد أقرب إلى SIV. في هذا الصدد ، اقترح VM Zhdanov أن فيروسات HIV-1 و HIV-2 و SIV نشأت من سلف مشترك. ومن الممكن، وفقا لR. جالو، واحدة من SIV على نحو ما حصل في جسم الإنسان، والتي شهدت عددا من الطفرات التي تؤدي إلى أي HIV-1، HIV-2 والأشكال الأخرى.
أعراض العدوى بفيروس نقص المناعة البشرية
يتميز فيروس نقص المناعة البشرية بميزات معينة ، تعتمد عليها المرض بشكل كبير. يحتوي الفيروس على نسبة عالية جدًا من التكاثر ، تحددها عناصره التنظيمية (يتم تصنيع 5000 virions خلال 5 دقائق في المرحلة النشطة). بسبب وجود بروتين الاندماج (gp41) ، يقوم الفيروس بتحفيز تكوين بنية مخلقة واسعة بسبب انصهار مساعدي T المصاب وغير المصاب ، مما يؤدي إلى موتهم الجماعي. جزيئات gpl20 جزيء كبير تنتشر بحرية في الدم وترتبط بمستقبلات مساعدي T غير المصابين ، ونتيجة لذلك يتم التعرف عليها وتدميرها من قبل T-killers. يمكن للفيروس أن ينتشر عبر القنوات البينخلوية من الخلية إلى الخلية ، وفي هذه الحالة يصبح أقل سهولة في الحصول على الأجسام المضادة.
المعايير السريرية للإصابة بفيروس نقص المناعة البشرية
إنشاء الكبار فيروس نقص المناعة البشرية إذا كان لديهم اثنين على الأقل من أعراض خطيرة في تركيبة مع أعراض واحد على الأقل من قاصر في حالة عدم وجود أسباب أخرى معروفة من نقص المناعة (السرطان، نقص المناعة الخلقي والجوع الشديد، وهلم جرا. P.). تشمل الأعراض الخطيرة ما يلي:
- فقدان الوزن بنسبة 10٪ أو أكثر ؛
- حمى طويلة الأمد ، متقطعة أو مستمرة ؛
- الإسهال المزمن.
وتشمل أعراض طفيفة السعال المستمر والتهاب الجلد معمم، المتكررة الحلأ النطاقي، المبيضات من تجويف الفم والبلعوم والمزمن الهربس البسيط، تضخم العقد اللمفية المعمم. يتم تشخيص الإيدز مع وجود ساركوما كابوزي فقط ، والتهاب السحايا بالمستخفيات ، والالتهاب الرئوي الرئوي. تتأثر الصورة السريرية للمرض بالعدوى الانتهازية.
طرق زراعة فيروس نقص المناعة البشرية (فيروس نقص المناعة البشرية)
يمكن استزراع فيروس العوز المناعي البشري -1 وفيروس العوز المناعي البشري -2 في خلايا نسخة واحدة فقط من الخلايا اللمفاوية TCB4 - H9 ، تم الحصول عليها من اللمفاويات اللمفاوية TCV4. لنفس الأغراض ، يمكن أيضا استخدام الثقافات أحادية الطبقة للخلايا النجمية ، حيث يتكاثر فيروس HIV-1 بشكل جيد. من الحيوانات إلى 1-الشمبانزي
مقاومة الفيروس في البيئة الخارجية منخفضة. يموت تحت تأثير أشعة الشمس وأشعة فوق البنفسجية ، وتدمر عند 80 درجة مئوية لمدة 30 دقيقة ، عندما تعامل مع المطهرات المستخدمة عادة - لمدة 20-30 دقيقة. لتطهير المواد التي تحتوي على الفيروس ، من الضروري استخدام المطهرات الفطرية ، لأنها فعالة ضد الكائنات الدقيقة ذات المقاومة الأعلى.
التشخيص المختبري للإصابة بفيروس نقص المناعة البشرية
الطريقة الرئيسية لتشخيص العدوى بالفيروس وفيروس نقص المناعة البشرية هي المناعية الإنزيمية. ومع ذلك، ويرجع ذلك إلى حقيقة أن gpl20 ديه التشابه الهيكلي والأنتيجين لمستقبلات معينة الخلايا البشرية، بما في ذلك المستقبلات التي تنفذ نقل المناعية عن طريق الخلايا الظهارية في الأغشية المخاطية في الجسم قد تظهر الأجسام المضادة الأجسام المضادة المرتبطة ضد gpl20. في هذه الحالة ، قد تكون هناك نتائج إيجابية خاطئة من IFM. لذلك ، تخضع جميع الأمصال تفاعل إيجابي من الدراسة لتحليل إضافي من قبل طريقة طخة مناعية ، أو النشاف الغربي. تعتمد هذه الطريقة على تحديد الأجسام المضادة التي يجب دراستها بعد الفصل الكهربي والفحص اللاحق مع الأجسام المضادة المضادة للفيروسات. إن الطريقة الفيروسية قليلة الاستخدام بسبب تعقيد ثقافة الفيروس. يتم استخدام نسخة من الخلايا الليمفاوية H9 للحصول على المستضدات الفيروسية - المكونات الضرورية لأنظمة الاختبار التشخيصية. تجعل طريقة CDR من الممكن اكتشاف الفيروس بالفعل في مرحلة مبكرة من viremia.
علاج عدوى فيروس نقص المناعة البشرية
من الضروري إيجاد أو تركيب العقاقير التي تمنع بشكل فعّال نشاط إنزيم المنتسخة العكسية (revertase) أو البروتيني الفيروسي. من شأنها أن تمنع تشكيل الحمض النووي من الفيروسات و (أو) تمنع تكاثر الفيروس داخل الخلايا. تعتمد الاستراتيجية الحالية لعلاج المصابين بفيروس نقص المناعة البشرية على مبدأ الاستخدام المشترك للأدوية التي تثبط البروتياز الفيروسي (أحد الأدوية) والارتداد (عقارين مختلفين) ، العلاج المركب (الثلاثي). في روسيا، لعلاج الأشخاص المصابين بفيروس نقص المناعة البشرية أوصى الجمع بين استخدام اثنين من العقاقير المحلية: Crixivan Phosphazide وعلى وجه التحديد تمنع تكاثر الفيروس في المراحل المبكرة والمتأخرة من التكاثر، خصوصا مع انخفاض النشاط من AZT.
مشكلة الوقاية المحددة هي الحاجة إلى إنشاء لقاح يضمن تكوين مناعة فعالة للخلايا تعتمد على الخلايا الليمفاوية السامة للخلايا بدون أي إنتاج هام للأجسام المضادة. يتم توفير هذه المناعة من قبل Thl-helpers. من الممكن أن الأجسام المضادة ، بما في ذلك تحييد الفيروسات ، ليست فعالة فقط في قمع الإصابة بفيروس نقص المناعة البشرية ، ولكن على مستوى عال تقوم بقمع المناعة الخلوية. ولذلك ، يجب أن يفي اللقاح المضاد لفيروس نقص المناعة البشرية في الأساس بمتطلبين أساسيين: أ) يكون آمنًا تمامًا ، ب) يحفز نشاط الخلايا الليمفاوية التائية السامة للخلايا. يتم دراسة فعالية مختلف أنواع اللقاحات التي تم الحصول عليها من الفيروسات (المعطلة) والفيروسات من مستضدات الفردية مع خصائص واقية عالية. يمكن أن تكون مستضدات مثل هذه معزولة عن الفيريونات نفسها ، أو توليفها كيميائيا. يقترح لقاح يستند إلى أساليب الهندسة الوراثية. وهو فيروس لقاح مؤتلف يحمل جينات فيروس نقص المناعة البشرية المسؤولة عن توليف المستضدات ذات الخصائص المناعية القوية. يستغرق اتخاذ قرار بشأن فعالية هذه اللقاحات وقتا طويلا بسبب طول فترة حضانة العدوى بفيروس نقص المناعة البشرية والتغير الكبير في العوامل المسببة للأمراض. إن إيجاد لقاح فعال ضد فيروس نقص المناعة البشرية مشكلة أساسية ملحة.


 [
[