خبير طبي في المقال
منشورات جديدة
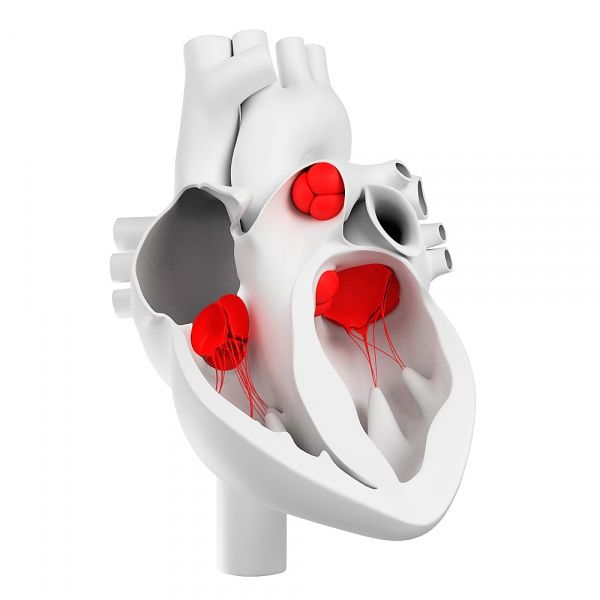
صمامات القلب
آخر مراجعة: 04.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
كان يُعتقد سابقًا أن جميع صمامات القلب هياكل بسيطة، تُسهم في تدفق الدم أحادي الاتجاه بحركة سلبية استجابةً لتدرج الضغط المطبق. أدى هذا الفهم لـ"الهياكل السلبية" إلى تطوير بدائل صمامات ميكانيكية وبيولوجية "سلبية".
أصبح من الواضح الآن أن صمامات القلب أكثر تعقيدًا في بنيتها ووظيفتها. لذلك، يفترض تطوير بديل "نشط" لصمام القلب تشابهًا كبيرًا في بنيته ووظيفته مع صمام القلب الطبيعي، وهو أمرٌ واقعيٌّ للغاية في المستقبل بفضل تطور هندسة الأنسجة.
تتطور صمامات القلب من بدايات جنينية للنسيج المتوسطي أثناء تكوين الشغاف. وخلال عملية التكوّن، تتشكل القناة الأذينية البطينية (الصمامات القلبية ثلاثية الشرفات والتاجية) ومسار التدفق البطيني (الصمامات القلبية الأبهري والرئوي).
كيف يتم ترتيب صمامات القلب؟
بدأ دراسة إمداد الدم إلى الصمامات على يد ن. لوشكا (1852)، الذي حقن أوعية القلب بمادة تباين. اكتشف العديد من الأوعية الدموية في شرفات الصمامات الأذينية البطينية والهلالية للشريان الأورطي والشريان الرئوي. في الوقت نفسه، احتوى عدد من الأدلة حول التشريح المرضي وعلم الأنسجة على مؤشرات على أن صمامات القلب البشرية غير المتغيرة لا تحتوي على أوعية دموية، وأن هذه الأخيرة تظهر في الصمامات فقط في عمليات مرضية مختلفة - تصلب الشرايين والتهاب الشغاف من مسببات مختلفة. استندت المعلومات حول غياب الأوعية الدموية بشكل أساسي على الدراسات النسيجية. افتُرض أنه في حالة عدم وجود أوعية دموية في الجزء الحر من الشرفات، يحدث تغذيتها عن طريق ترشيح السوائل من بلازما الدم التي تغسل الشرفات. لوحظ اختراق عدد قليل من الأوعية الدموية مع ألياف الأنسجة العضلية المخططة في قواعد الصمامات والأوتار الوترية.
ولكن عند حقن الأوعية القلبية بمختلف الأصباغ (الحبر الهندي في الجيلاتين، البزموت في الجيلاتين، المعلق المائي للحبر الهندي الأسود، محاليل القرمزي أو الأزرق التريباني)، وجد أن الأوعية تخترق صمامات القلب الأذينية البطينية، والصمامات الأورطية والشريان الرئوي مع أنسجة عضلة القلب، قبل الوصول إلى الحافة الحرة للصمام بقليل.
في النسيج الضام الليفي الرخو لقم الصمام الأذيني البطيني، تم العثور على أوعية رئيسية فردية متصلة بأوعية في المناطق المجاورة لأنسجة العضلات المخططة للقلب.
تم العثور على أكبر عدد من الأوعية الدموية في القاعدة وعدد أصغر نسبيًا في الجزء الحر من هذه الصمامات.
وفقًا لـ KI Kulchitsky et al. (1990)، يوجد قطر أكبر للأوعية الشريانية والوريدية في الصمام التاجي. توجد في قاعدة شرفات هذا الصمام بشكل أساسي الأوعية الرئيسية ذات شبكة ضيقة من الشعيرات الدموية، تخترق الجزء القاعدي من الشرفة وتشغل 10٪ من مساحتها. في الصمام ثلاثي الشرفات، يكون قطر الأوعية الشريانية أصغر من قطر الصمام التاجي. توجد في شرفات هذا الصمام بشكل أساسي أوعية متناثرة وحلقات واسعة نسبيًا من الشعيرات الدموية. في الصمام التاجي، يتم تزويد الشرفة الأمامية بالدم بشكل أكثر كثافة، في الصمام ثلاثي الشرفات - الشرفات الأمامية والخلفية، والتي تؤدي وظيفة الإغلاق الرئيسية. نسبة أقطار الأوعية الشريانية والوريدية في الصمامات الأذينية البطينية في قلب الأشخاص الناضجين هي 1: 1.5. الحلقات الشعرية متعددة الأضلاع وتقع عمودية على قاعدة شرفات الصمام. تشكل الأوعية شبكة مستوية تقع تحت البطانة على الجانب الأذيني. توجد الأوعية الدموية أيضًا في الحبال الوترية، حيث تخترق من العضلات الحليمية للبطينين الأيمن والأيسر على مسافة تصل إلى 30٪ من طول الحبال الوترية. تشكل العديد من الأوعية الدموية حلقات مقوسة عند قاعدة الحبال الوترية. تختلف صمامات القلب في الشريان الأورطي والجذع الرئوي بشكل كبير عن الصمامات الأذينية البطينية من حيث إمداد الدم. تقترب الأوعية الرئيسية ذات القطر الأصغر نسبيًا من قاعدة الشرفات الهلالية للشريان الأورطي وصمامات الجذع الرئوي. تنتهي الفروع القصيرة لهذه الأوعية بحلقات شعرية ذات شكل بيضاوي ومضلع غير منتظم. تقع بشكل رئيسي بالقرب من قاعدة الشرفات الهلالية. الأوعية الوريدية عند قاعدة الصمامين الأبهري والرئوي أصغر قطرًا من تلك الموجودة عند قاعدة الصمامين الأذيني البطيني. نسبة أقطار الأوعية الشريانية والوريدية في الصمامين الأبهري والرئوي لقلب البالغين هي 1:1.4. تمتد فروع جانبية قصيرة من الأوعية الأكبر، وتنتهي بحلقات من الشعيرات الدموية ذات أشكال بيضاوية ومضلعة غير منتظمة.

مع التقدم في السن، تتقلص ألياف النسيج الضام، سواءً الكولاجينية أو المرنة، ويقل حجم النسيج الضام الليفي غير المتشكل، ويتطور تصلب أنسجة شرفات الصمام الأذيني البطيني والشرفات الهلالية لصمامات الشريان الأورطي والرئوي. يتناقص طول ألياف العضلات المخططة في الصمامات، وبالتالي تقل كميتها وعدد الأوعية الدموية التي تخترقها. ونتيجةً لهذه التغيرات، تفقد صمامات القلب خصائصها المرنة والقابلة للتحمل، مما يؤثر على آلية إغلاق الصمام وديناميكا الدم.
تحتوي صمامات القلب على شبكات من الشعيرات اللمفاوية وعدد قليل من الأوعية اللمفاوية المجهزة بصمامات. تتميز الشعيرات اللمفاوية في الشرفات بمظهر مميز: تجويفها غير متساوٍ للغاية، والشعرية نفسها في مناطق مختلفة لها قطر مختلف. في الأماكن التي تندمج فيها العديد من الشعيرات الدموية، تتشكل توسعات - فجوات بأشكال مختلفة. غالبًا ما تكون حلقات الشبكات مضلعة غير منتظمة، ونادرًا ما تكون بيضاوية أو مستديرة. غالبًا ما تكون حلقات الشبكات اللمفاوية غير مغلقة، وتنتهي الشعيرات اللمفاوية بشكل أعمى. يتم توجيه حلقات الشعيرات اللمفاوية في أغلب الأحيان في الاتجاه من الحافة الحرة للشرفة إلى قاعدتها. في بعض الحالات، تم العثور على شبكة من طبقتين من الشعيرات اللمفاوية في شرفات الصمام الأذيني البطيني.
تقع ضفائر الأعصاب الشغافية في طبقاتها المختلفة، وخاصةً تحت البطانة الغشائية. عند الحافة الحرة لشرفات الصمام، تتوضع الألياف العصبية بشكل شعاعي بشكل رئيسي، متصلةً بألياف الحبال الوترية. وبالقرب من قاعدة الشرفات، تتشكل ضفيرة عصبية شبكية كبيرة تتصل بالضفيرة المحيطة بالحلقات الليفية. على الشرفات الهلالية، تكون شبكة الأعصاب الشغافية أقل كثافة. وفي مكان التقاء الصمامات، تصبح كثيفة ومتعددة الطبقات.
البنية الخلوية لصمامات القلب
الخلايا الخلالية الصمامية، المسؤولة عن الحفاظ على بنية الصمام، مستطيلة الشكل مع العديد من النتوءات الدقيقة التي تمتد عبر مصفوفة الصمام. هناك مجموعتان من الخلايا الخلالية الصمامية تختلفان في الشكل والبنية؛ إحداهما ذات خصائص انقباضية وتتميز بوجود لييفات انقباضية، والأخرى ذات خصائص إفرازية وتحتوي على شبكة إندوبلازمية متطورة وجهاز جولجي. تقاوم وظيفة الانقباض الضغط الديناميكي الدموي، ويدعمها أيضًا إنتاج كل من البروتينات الانقباضية القلبية والهيكلية، والتي تشمل السلاسل الثقيلة من ألفا وبيتا ميوسين ومختلف أشكال التروبونين. وقد ثبت أن انقباض وريقة صمام القلب استجابة لعدد من العوامل النشطة في الأوعية الدموية، مما يشير إلى وجود حافز بيولوجي منسق لنجاح وظيفة الصمام.
تُعد الخلايا الخلالية أيضًا مكونات أساسية في نظام إصلاح هياكل مثل صمامات القلب. تُسبب الحركة المستمرة لوريقات الصمامات، وما يصاحبها من تشوه في النسيج الضام، تلفًا تستجيب له الخلايا الخلالية الصمامية للحفاظ على سلامة الصمام. ويبدو أن عملية الإصلاح حيوية لوظيفة الصمام الطبيعية، ومن المرجح أن يكون غياب هذه الخلايا في نماذج الصمامات الاصطناعية الحالية عاملًا مساهمًا في التلف الهيكلي للأطراف الصناعية الحيوية.
من أهم مجالات البحث في الخلايا الخلالية دراسة التفاعلات بينها وبين المصفوفة المحيطة بها، والتي تتم بوساطة جزيئات الالتصاق البؤري. الالتصاقات البؤرية هي مواقع تفاعل متخصصة بين الخلايا والمصفوفة، تربط الهيكل الخلوي للخلية ببروتينات المصفوفة عبر الإنتغرينات. كما تعمل كمواقع لنقل الإشارات، حيث تنقل المعلومات الميكانيكية من المصفوفة خارج الخلية، مما يُحفز استجابات تشمل، على سبيل المثال لا الحصر، التصاق الخلايا، والهجرة، والنمو، والتمايز. يُعد فهم البيولوجيا الخلوية للخلايا الخلالية الصمامية أمرًا بالغ الأهمية لتوضيح آليات تفاعل هذه الخلايا مع بعضها البعض ومع بيئتها، بحيث يُمكن إعادة تمثيل هذه الوظيفة في الصمامات الاصطناعية.
في إطار تطوير اتجاه واعد في هندسة أنسجة صمامات القلب، تُجرى دراسات على الخلايا الخلالية باستخدام مجموعة واسعة من التقنيات. يُؤكد وجود الهيكل الخلوي للخلية بصبغ الفيمنتين، والديسمين، والتروبونين، وألفا-أكتين، وميوسين العضلات الملساء، والسلاسل الثقيلة من ألفا وبيتا-ميوسين، والسلاسل الخفيفة-2 من ميوسين القلب، وألفا وبيتا-توبولين. تُؤكد انقباضية الخلايا باستجابة إيجابية للأدرينالين، والأنجيوتنسين II، والبراديكينين، والكارباكول، وكلوريد البوتاسيوم، والبطانة I. تُحدد العلاقات المتبادلة بين الخلايا من خلال تفاعلات الفجوات الوظيفية، ويُتحقق منها عن طريق الحقن المجهري للكاربوكسي فلوريسئين. يُحدد إفراز المصفوفة بصبغ بروليل-4-هيدروكسيلاز/كولاجين من النوع II، وفيبرونيكتين، وكبريتات شوندرويتين، ولامينين. يُنشأ التعصيب من خلال تقارب النهايات العصبية الحركية، والذي ينعكس في نشاط إنزيم نيوروببتيد Y تيروزين هيدروكسيلاز، وأستيل كولينستراز، والببتيد المعوي الوعائي، والمادة P، والببتيد المرتبط بجين الفلفل الحار. تُقدر العوامل المولدة للانقسام الخلوي بواسطة عامل النمو المشتق من الصفائح الدموية، وعامل نمو الخلايا الليفية الأساسية، والسيروتونين (5-HT). تتميز الخلايا الليفية الخلوية الخلالية المدروسة بغشاء قاعدي غير مكتمل، وعمليات سيتوبلازمية طويلة ورفيعة، واتصال وثيق بالمصفوفة، وشبكة إندوبلازمية غير متساوية متطورة جيدًا وجهاز جولجي، ووفرة في الخيوط الدقيقة، وتكوين روابط لاصقة.
تُشكّل خلايا الشغاف الصمامية غمدًا وظيفيًا مُخَثِّرًا حول كل صمام قلبي، يُشبه بطانة الأوعية الدموية. تُلغي طريقة استبدال الصمامات الشائعة الوظيفة الوقائية للشغاف، مما قد يؤدي إلى ترسب الصفائح الدموية والفيبرين على الصمامات الاصطناعية، وتطور عدوى بكتيرية، وتكلس الأنسجة. ومن الوظائف المُحتملة الأخرى لهذه الخلايا تنظيم الخلايا الخلالية الصمامية الكامنة، على غرار تنظيم خلايا العضلات الملساء بواسطة بطانة الأوعية الدموية. توجد تفاعلات مُعقّدة بين بطانة الأوعية الدموية والخلايا المجاورة، يتوسطها جزئيًا عوامل قابلة للذوبان تُفرزها خلايا بطانة الأوعية الدموية. تُشكّل هذه الخلايا سطحًا ضخمًا مُغطى بنتوءات دقيقة على الجانب اللمعي، مما يزيد من التعرض والتفاعل المُحتمل مع المواد الأيضية في الدم الدائر.
غالبًا ما تُظهر البطانة اختلافات مورفولوجية ووظيفية ناتجة عن إجهادات القص على جدار الأوعية الدموية بسبب تدفق الدم، وينطبق هذا أيضًا على خلايا الشغاف الصمامية، التي تتخذ شكلًا مستطيلًا أو مضلعًا. قد تحدث تغيرات في بنية الخلية نتيجةً لتأثير ديناميكا الدم الموضعية على مكونات الهيكل الخلوي للخلية، أو تأثيرات ثانوية ناتجة عن تغيرات في المصفوفة خارج الخلوية الأساسية. على المستوى فوق البنيوي، تمتلك خلايا الشغاف الصمامية وصلات بين الخلايا، وحويصلات بلازمية، وشبكة إندوبلازمية خشنة، وجهاز جولجي. على الرغم من أنها تنتج عامل فون ويلبراند في الجسم الحي وفي المختبر، إلا أنها تفتقر إلى أجسام ويبل-بالاد (حبيبات محددة تحتوي على عامل فون ويلبراند)، وهي عضيات مميزة للبطانة الوعائية. تتميز خلايا الشغاف الصمامية بوصلات قوية، وتفاعلات وظيفية بين الفجوات، وطيات هامشية متداخلة.
تحتفظ خلايا الشغاف بنشاطها الأيضي حتى في المختبر: فهي تُنتج عامل فون ويلبراند، وبروستاسيكلين، وأكسيد النيتريك سينثيز، وتُظهر نشاط إنزيم تحويل الأنجيوتنسين، وتُفرز بكثافة جزيئات الالتصاق ICAM-1 وELAM-1، وهي جزيئات مهمة لربط الخلايا وحيدة النواة أثناء تطور الاستجابة المناعية. يجب أخذ جميع هذه العلامات في الاعتبار عند زراعة مزرعة خلوية مثالية لإنشاء صمام اصطناعي باستخدام هندسة الأنسجة، إلا أن قدرة خلايا الشغاف الصمامية على تحفيز المناعة قد تُحد من استخدامها.
تتكون المصفوفة خارج الخلية لصمامات القلب من جزيئات ليفية من الكولاجين والإيلاستين، بالإضافة إلى البروتيوغليكان والجليكوبروتينات. يشكل الكولاجين 60% من الوزن الجاف للصمام، والإيلاستين 10%، والبروتيوغليكان 20%. يوفر مكون الكولاجين الاستقرار الميكانيكي الرئيسي للصمام، ويمثله الكولاجين من النوع الأول (74%)، والثاني (24%)، والخامس (2%). تُحاط حزم خيوط الكولاجين بغلاف من الإيلاستين، الذي يُسهل التفاعلات بينها. تميل السلاسل الجانبية من الجليكوزامينوغليكان لجزيئات البروتيوغليكان إلى تكوين مادة هلامية تتفاعل فيها جزيئات المصفوفة الأخرى لتكوين روابط دائمة، وتترسب مكونات أخرى. تتكون غليكوز أمينوغليكان صمامات القلب البشرية بشكل رئيسي من حمض الهيالورونيك، وبدرجة أقل من كبريتات الديرماتان، وكبريتات الكوندرويتين-4، وكبريتات الكوندرويتين-6، مع كمية ضئيلة من كبريتات الهيباران. تُنظم إعادة تشكيل وتجديد أنسجة المصفوفة بواسطة ميتالوبروتينازات المصفوفة (MMPs) ومثبطاتها النسيجية (TIs). كما تشارك هذه الجزيئات في مجموعة واسعة من العمليات الفسيولوجية والمرضية. توجد بعض ميتالوبروتينازات، بما في ذلك الكولاجينازات الخلالية (MMP-1، MMP-13) والجيلاتينازات (MMP-2، MMP-9) ومثبطاتها النسيجية (TI-1، TI-2، TI-3)، في جميع صمامات القلب. يُعدّ الإنتاج الزائد لميتالوبروتينازات سمةً مميزةً للحالات المرضية في صمام القلب.
 [ 6 ]، [ 7 ]، [ 8 ]، [ 9 ]، [ 10 ]، [ 11 ]، [ 12 ]، [ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]
[ 6 ]، [ 7 ]، [ 8 ]، [ 9 ]، [ 10 ]، [ 11 ]، [ 12 ]، [ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]
صمامات القلب وبنيتها المورفولوجية
تتكون صمامات القلب من ثلاث طبقات من مصفوفة الصمامات، مختلفة شكليًا ووظيفيًا: الليفية، والإسفنجية، والبطينية.
تُشكّل الطبقة الليفية إطارًا مقاومًا للضغط لوريقة الصمام، وتتكون من طبقات من ألياف الكولاجين. ترتّب هذه الألياف شعاعيًا في طيات تسمح للصمامات الشريانية بالتمدد عند الانغلاق. تقع الطبقة الليفية بالقرب من السطح الخارجي لمخرج هذه الصمامات. تُشكّل الطبقة الليفية للصمامات الأذينية البطينية امتدادًا لحزم الكولاجين في الحبال الوترية. تقع بين الطبقة الإسفنجية (المدخلة) والطبقة البطينية (المخرجة).
تقع الطبقة الإسفنجية بين الطبقة الليفية والطبقة البطينية. تتكون هذه الطبقة من نسيج ضام ضعيف التنظيم في وسط لزج. المكونات المهيمنة في هذه الطبقة هي بروتيوجليكانات مع كولاجين عشوائي التوجه وطبقات رقيقة من الإيلاستين. تحمل السلاسل الجانبية لجزيئات البروتيوجليكانات شحنة سالبة قوية، مما يؤثر على قدرتها العالية على ربط الماء وتكوين هلام مصفوفة مسامي. تقلل الطبقة الإسفنجية من المصفوفة من الإجهاد الميكانيكي في وريقات صمام القلب وتحافظ على مرونتها.
الطبقة البطينية أرق بكثير من الطبقات الأخرى، وهي غنية بالألياف المرنة التي تسمح للأنسجة بمقاومة التشوه المستمر. يتميز الإيلاستين ببنية إسفنجية تحيط بألياف الكولاجين وتربطها، وتحافظ عليها في حالة طيّ محايدة. تحتوي طبقة مدخل الصمام (البطينية - للصمامات الشريانية، والإسفنجية - للأذينية البطينية) على كمية من الإيلاستين أكبر من طبقة المخرج، مما يُخفف من تأثير الصدمة الهيدروليكية عند انغلاق الشرفات. تسمح هذه العلاقة بين الكولاجين والإيلاستين للشرفات بالتمدد بنسبة تصل إلى 40% دون تشوه ثابت. عند تعرضها لضغط خفيف، تتجه هياكل الكولاجين في هذه الطبقة في اتجاه الضغط، وتزداد مقاومتها لنمو الضغط.
وبالتالي، فإن فكرة أن صمامات القلب مجرد تضاعفات شغافية ليست مُبسَّطة فحسب، بل هي خاطئة جوهريًا. صمامات القلب أعضاء مُعقَّدة تشمل أليافًا عضلية مُخطَّطة، وأوعية دموية ولمفاوية، وعناصر عصبية. تُعَدّ الصمامات، من حيث بنيتها ووظيفتها، جزءًا لا يتجزأ من جميع هياكل القلب. يجب أن يُراعي تحليل وظيفة الصمام الطبيعية تنظيمه الخلوي، بالإضافة إلى تفاعل الخلايا مع بعضها البعض ومع المصفوفة. تُمثِّل المعرفة المُستقاة من هذه الدراسات ركيزةً أساسيةً في تصميم وتطوير الصمامات الاصطناعية باستخدام هندسة الأنسجة.

