خبير طبي في المقال
منشورات جديدة
متلازمة شيرج ستروس
آخر مراجعة: 04.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
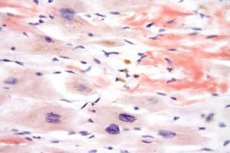
سُميت متلازمة شيرغ-ستراوس تيمنًا بالعالمين شيرغ وستراوس، اللذين وصفا هذا المرض لأول مرة. يُعد هذا المرض نوعًا منفصلًا من التهاب الأوعية الدموية - التهاب الأوعية الدموية التحسسي والورم الحبيبي - يُصيب بشكل رئيسي الأوعية الدموية المتوسطة والصغيرة. كما يُصاحب المرض أمراضًا أخرى مثل الالتهاب الرئوي، وفرط الحمضات، والربو القصبي. في السابق، كان هذا المرض يُعتبر نوعًا ربويًا من التهاب الشرايين العقدي حول الشريان، ولكنه الآن يُصنف كنوع مستقل في تصنيف الأمراض.
في عام ١٩٥١، وصف شيرغ وشتراوس (ستراوس) هذه المتلازمة لأول مرة لدى ١٣ مريضًا يعانون من الربو، وفرط الحمضات، والالتهاب الحبيبي، والتهاب الأوعية الدموية الجهازية الناخر، والتهاب كبيبات الكلى الناخر. في عام ١٩٩٠، اقترحت الكلية الأمريكية لأمراض الروماتيزم (ACR) المعايير الستة التالية لتشخيص متلازمة شيرغ-ستراوس:
- الربو ( الصفير، الصفير عند الزفير).
- - زيادة عدد الحمضات (أكثر من 10%).
- التهاب الجيوب الأنفية.
- ارتشاحات رئوية (قد تكون مؤقتة).
- دليل نسيجي على التهاب الأوعية الدموية مع وجود الحمضات خارج الأوعية الدموية.
- التهاب الأعصاب المتعدد أو التهاب الأعصاب المتعدد.
وجود أربعة معايير أو أكثر له خصوصية بنسبة 99.7%.
علم الأوبئة
تُشكل متلازمة شيرغ-ستراوس حوالي 20% من حالات التهاب الأوعية الدموية من فئة التهاب الشرايين العقدي. يبدأ هذا المرض بالتطور في المتوسط عند حوالي 44 عامًا. في الوقت نفسه، يكون الرجال أكثر عرضة للإصابة به بنسبة 1.3 مرة.
يبلغ معدل الإصابة بمتلازمة شيرج شتراوس في الولايات المتحدة 1-3 حالات لكل 100 ألف بالغ سنويًا وحوالي 2.5 حالة لكل 100 ألف بالغ سنويًا في جميع أنحاء العالم.
الأسباب متلازمة شيرج ستروس
لم تُحدد أسباب هذه المتلازمة بعد. تعتمد آلية تطورها على الالتهاب المناعي، والعمليات التدميرية والتكاثرية، بالإضافة إلى انخفاض نفاذية جدران الأوعية الدموية، وتكوين جلطات الدم، وتطور نقص التروية في منطقة تدمير الأوعية الدموية والنزيف. بالإضافة إلى ذلك، يُعد ارتفاع مستوى ANCA عاملًا مهمًا في تطور المتلازمة، حيث يُعادل المستضد إنزيمات العدلات (خاصةً البروتيناز-3، بالإضافة إلى الميلوبيروكسيديز). في الوقت نفسه، تُسبب ANCA اضطرابًا في الحركة عبر البطانة للخلايا الحبيبية النشطة، كما تُسبب إزالة التحبب المبكرة. بسبب التغيرات في الأوعية الدموية، تظهر ارتشاحات رئوية في الأعضاء والأنسجة، مما يؤدي إلى تطور التهاب عقدي نخري.
يمكن أن تكون العوامل المحفزة لتطور متلازمة شيرغ شتراوس عدوى بكتيرية أو فيروسية (على سبيل المثال، عدوى البلعوم الأنفي بالمكورات العنقودية أو التهاب الكبد من النوع ب)، أو مسببات الحساسية المختلفة، أو عدم تحمل بعض الأدوية، أو التطعيم، أو التبريد المفرط، أو الإجهاد، أو الحمل أو الولادة، أو التعرض لأشعة الشمس.
قد يكون وجود HLA-DRB4 عامل خطر وراثي لتطور متلازمة شيرغ شتراوس وقد يزيد من احتمالية الإصابة بالمظاهر الالتهابية الوعائية للمرض.
عوامل الخطر
هذا المرض نادرٌ جدًا، ورغم أن العديد من الأشخاص معرضون لعوامل الخطر، إلا أنه يصيب نسبةً ضئيلةً فقط من السكان. من بين هذه العوامل:
- العمر - معظم مرضى هذه المتلازمة تتراوح أعمارهم بين 38 و52 عامًا. نادرًا ما يتطور هذا المرض لدى كبار السن أو الأطفال.
- لدى المريض تاريخٌ من التهاب الأنف التحسسي أو الربو. معظم مرضى متلازمة شيرغ-ستراوس سبق لهم الإصابة بأحد هذه الأمراض (وغالبًا ما كانت الحالة حادة).
الأعراض متلازمة شيرج ستروس
بالإضافة إلى الأعراض غير المحددة التي تُلاحظ أيضًا في حالة التهاب الشرايين العقدي (وهي حالة من الحمى وفقدان الشهية وفقدان الوزن والشعور بالضيق)، فإن العرض الرئيسي هو اضطراب في وظائف الرئتين. ونتيجة لذلك، يبدأ الربو القصبي الحاد، ويحدث سواد في الرئتين، وهو ما يُؤكده تصوير الصدر بالأشعة السينية، والذي غالبًا ما يختفي بسرعة - وهو ما يُعرف بـ ELI المتطاير.
من بين الأعراض الرئيسية لهذه الحالة المرضية متلازمة GRB، والتي عادةً ما تكون مقدمة لظهور العلامات السريرية لالتهاب الأوعية الدموية الجهازي. كما يُلاحظ غالبًا وجود أمراض رئوية معدية، متبوعةً بتطور الربو القصبي من النوع المعتمد على العدوى، بالإضافة إلى مرض توسع القصبات. تُلاحظ ارتشاحات رئوية لدى ثلثي المرضى المصابين بالمتلازمة. ويُشخص حوالي ثلث المرضى بالتهاب الجنبة مع زيادة في عدد الحمضات في السائل الجنبي.
عند إصابة الجهاز الهضمي، يبدأ ظهور ألم في البطن وإسهال، وفي حالات نادرة، نزيف. وينشأ تطور هذه الأعراض إما عن التهاب المعدة والأمعاء اليوزيني أو التهاب الأوعية الدموية في جدار الأمعاء. ويمكن أن يسبب هذا المرض الأخير التهاب الصفاق، أو تدميرًا كاملًا لجدار الأمعاء، أو انسدادًا معويًا.
تظهر المظاهر السريرية لاضطرابات القلب لدى ثلث المرضى، إلا أنها تُكتشف عند تشريح الجثث في 62% من الحالات، وهو ما يُسبب الوفاة في 23% منها. وتُلاحظ تغيرات مختلفة في قراءات تخطيط كهربية القلب لدى حوالي نصف المرضى. ويُصاحب حوالي ثلث حالات المرض قصور القلب أو التهاب التامور بشكل حاد أو انقباضي. ونادرًا ما يُصاب المرضى بارتفاع ضغط الدم واحتشاء عضلة القلب.
تُلاحظ أمراض جلدية لدى 70% من المرضى، وهي أكثر شيوعًا في حالة التهاب الأوعية الدموية النخاعي مقارنةً بالتهاب الشرايين العقدي. من بين الأعراض:
- طفح جلدي نزفي؛
- العقد الموجودة على الجلد وتحته؛
- احمرار الجلد؛
- الشرى؛
- الخراجات الدقيقة في الجلد؛
- التزرق الشبكي.
يُعدّ مرض الكلى أقل الأعراض شيوعًا. ومع ذلك، فهو ليس بخطورة داء حبيبات ويجنر أو التهاب الشرايين العقدي. يعاني حوالي نصف مرضى هذه المتلازمة من التهاب كلوي بؤري، والذي غالبًا ما يُسبب ارتفاع ضغط الدم الشرياني. قد يُصاب المرضى الذين لديهم أجسام مضادة للعدلات في البلازما بالتهاب كبيبات الكلى الناخر.
تصيب أمراض المفاصل (مثل التهاب المفاصل المتعدد) نصف مرضى هذه المتلازمة. وعادةً ما يُصابون بالتهاب المفاصل المهاجر غير التقدمي، الذي يُصيب المفاصل الصغيرة والكبيرة. وفي بعض الحالات، يُلاحظ التهاب أو ألم عضلي.
مراحل
عادة ما يمر متلازمة شيرغ شتراوس بثلاث مراحل رئيسية (بشكل مشروط) أثناء تطورها.
في الفترة الأولية (يمكن أن تستمر لمدة 30 عامًا)، يعاني المرضى من الحساسية المتكررة، بما في ذلك الربو، وحمى القش، والتهاب الأنف.
في المرحلة الثانية، يبدأ عدد الخلايا الحمضية في الأنسجة والدم بالازدياد. في هذه المرحلة، غالبًا ما يُشخَّص المرضى بمتلازمة لوفلر، أو تسلل رئوي مصحوب بفرط الحمضات، أو التهاب المعدة والأمعاء اليوزيني.
في المرحلة الثالثة، يظهر المرضى المظاهر السريرية لالتهاب الأوعية الدموية الجهازية.
المضاعفات والنتائج
ومن مضاعفات المرض الأكثر خطورة هو الالتهاب الرئوي الذي يتطور تحت تأثير بكتيريا Pneumocystis carini.
يُعدّ مرض التصلب العصبي المتعدد خطيرًا لأنه يُؤثّر على أعضاء مُختلفة، بما في ذلك القلب والرئتين والجلد والجهاز الهضمي والعضلات والمفاصل والكلى. إذا تُرك هذا المرض دون علاج، فقد يُؤدي إلى الوفاة. المضاعفات المُحتملة للمرض:
- اضطراب وظيفة الأعصاب الطرفية؛
- الحكة وتقرحات الجلد، فضلا عن المضاعفات المعدية؛
- التهاب التامور، وتطور التهاب عضلة القلب، بالإضافة إلى قصور القلب والنوبات القلبية؛
- التهاب كبيبات الكلى، حيث تفقد الكلى وظيفتها الترشيحية تدريجيًا، مما يؤدي إلى الفشل الكلوي.
تصنيف المخاطر
طورت مجموعة دراسة التهاب الأوعية الدموية الفرنسية نظامًا من خمس نقاط (خمسة عوامل) للتنبؤ بخطر الوفاة في متلازمة شيرج-ستراوس بناءً على السمات السريرية. هذه العوامل هي:
- انخفاض وظائف الكلى (الكرياتينين> 1.58 ملغ/ديسيلتر أو 140 ميكرومول/لتر)
- بيلة بروتينية (> 1 جم / 24 ساعة)
- نزيف الجهاز الهضمي، أو النوبة القلبية، أو التهاب البنكرياس
- تلف الجهاز العصبي المركزي
- اعتلال عضلة القلب
يشير غياب أيٍّ من هذه العوامل إلى مسار أخف، بمعدل وفيات خلال خمس سنوات يبلغ 11.9%. ويشير وجود عامل واحد إلى مرض شديد، بمعدل وفيات خلال خمس سنوات يبلغ 26%، بينما يشير وجود عاملين أو أكثر إلى مرض شديد للغاية: معدل وفيات 46% خلال خمس سنوات.
التشخيص متلازمة شيرج ستروس
من بين معايير التشخيص الرئيسية أعراضٌ مثل فرط الحمضات، والربو القصبي، وتاريخٌ من الحساسية. بالإضافة إلى ذلك، الالتهاب الرئوي اليوزيني، والاعتلال العصبي، والتهاب الجيوب الأنفية، وفرط الحمضات خارج الأوعية الدموية. إذا كان المريض يعاني من أربعةٍ على الأقل من هذه الأمراض، يُمكن تشخيص متلازمة التصلب العصبي المتعدد (SCS).
 [ 31 ]، [ 32 ]، [ 33 ]، [ 34 ]
[ 31 ]، [ 32 ]، [ 33 ]، [ 34 ]
الاختبارات
يتم أخذ الدم لإجراء تحليل عام: لتشخيص المرض، يجب أن يكون هناك فائض من الخلايا الحمضية بنسبة 10٪ فوق المعدل الطبيعي، وكذلك تسارع عملية ترسيب كريات الدم الحمراء.
يجب أن يكشف اختبار البول العام عن وجود البروتين في البول، بالإضافة إلى زيادة عدد خلايا الدم الحمراء.
خزعة عبر القصبات الهوائية والجلد والأنسجة تحت الجلد: في هذه الحالة، يجب الكشف عن تسلل واضح للخلايا الحمضية في جدران الأوعية الصغيرة، بالإضافة إلى العمليات الحبيبية النخرية في أعضاء الجهاز التنفسي.
التحليل المناعي للكشف عن ارتفاع مستويات أجسام مضادة للـ ANCA. ينصب التركيز هنا على ارتفاع مستويات IgE الكلي، بالإضافة إلى الأجسام المضادة المحيطة بالنواة ذات نشاط مضاد الميلوبيروكسيديز.
التشخيص الآلي
التصوير المقطعي المحوسب للرئتين - تتضمن العملية تصور مجموعات من الأنسجة الحشوية، تقع بشكل أساسي على المحيط؛ ومن الملاحظ أيضًا أن جدران القصبات الهوائية أصبحت سميكة، مع توسع في بعض الأماكن، كما أن توسع القصبات الهوائية ملحوظ.
- فحص الإفرازات في السائل الجنبي بالمجهر، وكذلك التنظير القصبي العلاجي للكشف عن كثرة الحمضات.
إجراء تخطيط صدى القلب للكشف عن أعراض ارتجاع الصمام الميترالي، وكذلك تكاثر النسيج الضام مع ظهور ندبات في عضلة القلب.
من الاتصال؟
علاج او معاملة متلازمة شيرج ستروس
علاج SCS معقد، حيث تُستخدم الأدوية المُثبطة للخلايا والجلوكوكورتيكوستيرويدات خلال العلاج. وبشكل عام، يُشبه العلاج مبادئ علاج التهاب الشرايين العقدي.
العلاج الدوائي
في حالة تلف الجهاز الهضمي، وكذلك الرئتين والكلى والجلد، يُنصح ببدء العلاج بالبريدنيزولون. الجرعة العلاجية هي 60 ملغ/يوم. بعد أسبوع إلى أسبوعين من تناول هذا الدواء، يُنتقل إلى الاستخدام الدوري للبريدنيزولون مع تخفيض الجرعة تدريجيًا. بعد 3 أشهر، في حال ملاحظة تحسن في الحالة، يُستمر تخفيض الجرعة إلى جرعة صيانة تُبقى لفترة طويلة.
إذا لم يُحدث بريدنيزولون أي تأثير، وكذلك في حالة ظهور أعراض اضطراب الجهاز العصبي المركزي المنتشر، وقصور تدفق الدم، واضطرابات التوصيل، يُوصف هيدروكسي يوريا داخليًا بجرعة 0.5-1 غ/يوم. إذا انخفض عدد كريات الدم البيضاء إلى 6-10x109/لتر، فمن الضروري الانتقال إلى استخدام الدواء بنظام علاجي كل يومين، أو في اليوم الثالث، أو التوقف عن تناوله لمدة شهرين إلى ثلاثة أشهر. يمكن أيضًا استخدام أدوية أخرى مثبطة للخلايا، مثل سيكلوفوسفاميد أو أزاثيوبرين.
إذا كان المريض يعاني من الربو القصبي، يتم وصف موسعات الشعب الهوائية.
يتم استخدام مضادات التخثر أو مضادات الصفائح الدموية (مثل حمض أسيتيل الساليسيليك بجرعة 0.15-0.25 جرام / يوم أو كورانتيل بجرعة 225-400 مجم / يوم) كإجراء وقائي ضد تطور المضاعفات الخثارية.
أظهرت مراجعة منهجية أجريت في عام 2007 فعالية الستيرويدات بجرعات عالية.
الفيتامينات
وبما أن الكورتيكوستيرويدات تؤثر سلباً على قوة العظام، فمن الضروري تعويض الخسارة عن طريق تناول الكمية المطلوبة من الكالسيوم، بالإضافة إلى استهلاك ما يقارب 2000 وحدة دولية من فيتامين د يومياً.
توقعات
إن تشخيص متلازمة شيرغ-ستراوس دون علاج في الوقت المناسب غير مواتٍ. في حالة تلف أعضاء متعددة، يتطور المرض بسرعة كبيرة، مما يزيد من خطر الوفاة نتيجة خلل في وظائف القلب والرئة. يتيح العلاج المناسب بقاء 60-80% من المرضى على قيد الحياة لمدة 5 سنوات.
الأسباب الرئيسية للوفاة في متلازمة شيرج شتراوس هي التهاب عضلة القلب واحتشاء عضلة القلب.

