خبير طبي في المقال
منشورات جديدة
دور التغيرات في العظام تحت الغضروفية في التسبب في هشاشة العظام
آخر مراجعة: 04.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
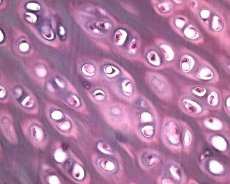
إلى جانب انحلال الغضروف المفصلي، يشارك النسيج العظمي الكامن أيضًا في العملية المرضية في هشاشة العظام. ويُفترض أن سماكة الصفيحة تحت الغضروف تُسهم في تطور هشاشة العظام. ومع تقدم هشاشة العظام، يتآكل الغضروف المفصلي، الذي يتعرض لإجهاد ميكانيكي وكيميائي، ببطء بسبب اختلال في عمليات هدم الغضروف وإصلاحه. وعلى وجه الخصوص، يُسهم الإجهاد الميكانيكي المتعلق بالمفاصل "التي تحمل" وزن الجسم في تكوين عدد كبير من الكسور الدقيقة في الصفيحة تحت الغضروف والغضروف. ومع تآكل الغضروف المفصلي، يتطور تصلب العظم تحت الغضروف، وتزداد صلابة النسيج العظمي، مما يُسهم بدوره في مزيد من الاضطراب في بنية الغضروف المفصلي. ومع ذلك، لا يزال السؤال حول الطبيعة الأولية أو الثانوية لتغيرات العظم تحت الغضروف في هشاشة العظام دون حل.
حتى وقت قريب، كانت التغيرات التي يمكن اكتشافها شعاعيًا في المادة الإسفنجية للعظم تحت الغضروفي، مثل التصلب أو تكوين الأكياس، تُعتبر ثانوية لدى مرضى الفصال العظمي. ومع ذلك، تشير نتائج الدراسات السريرية والتجريبية إلى دور محتمل للعظم تحت الغضروفي في التسبب بالفصال العظمي. إحدى الآليات المحتملة هي الزيادة الحادة في تدرج صلابة العظم تحت الغضروفي، نظرًا لأن سلامة النسيج الغضروفي الكامن تحته تعتمد على الخصائص الميكانيكية لطبقة العظم. أظهرت الدراسات التي أُجريت على الرئيسيات أن التغيرات في العظم تحت الغضروفي يمكن أن تسبق التغيرات في الغضروف المفصلي. وقد زادت الأدلة المؤيدة والمعارضة لهذه الفرضية، والتي ظهرت نتيجة دراسات أجريت على نماذج حيوانية للفصال العظمي والدراسات السريرية، من حدة الجدل. لا يصاحب سماكة العوارض العظمية تحت الغضروفية دائمًا زيادة في تمعدن العظام، أو بالأحرى، زيادة في حجم النسيج العظمي. تشير هذه العلامة على وجود تمعدن غير طبيعي إلى أن اضطراب تنظيم إعادة تشكيل العظام جزء لا يتجزأ من هشاشة العظام، كما تدعم مفهوم وجود خلل في خلايا العظام في هشاشة العظام. وتعتبر مجموعة ج. ديكيكر (1989) هذا الأخير "مرضًا عظميًا أيضيًا عامًا".
يتجدد نسيج العظم باستمرار. تُسمى هذه العملية الديناميكية إعادة تشكيل العظم، وهي عبارة عن سلسلة معقدة من الامتصاص والتمعدن. تمتص الخلايا الناقضة للعظم نسيج العظم، بينما تفرز الخلايا البانية للعظم البروتينات التي تُشكل المكون العضوي الرئيسي لعملية التمعدن. لا يحدث تكوين العظم وامتصاصه عشوائيًا في جميع أنحاء الهيكل العظمي؛ بل هو عملية مبرمجة تحدث في مناطق مختلفة من الهيكل العظمي، تُسمى وحدات إعادة تشكيل العظم. في بداية الدورة، تظهر الخلايا الناقضة للعظم على السطح غير النشط؛ وفي غضون أسبوعين، تُشكل نفقًا في العظم القشري أو فجوة على سطح العظم الإسفنجي. يُحدد تواتر تنشيط وحدات إعادة تشكيل العظم الجديدة درجة تجديد العظم. في الشخص الشاب السليم، تكون عمليات تكوين العظم وامتصاصه متوازنة، ويتم الحفاظ على كتلة العظام الطبيعية. في التنظيم الهرموني لامتصاص أنسجة العظام، يشارك كلٌّ من هرموني PTH وPGE2 على الأقل ، ليس فقط الخلايا الناقضة للعظم، بل أيضًا الخلايا البانية للعظم، إذ تُطلق هذه الهرمونات عوامل تُحفّز امتصاص العظم بواسطة الخلايا الناقضة للعظم. حاليًا، يُعرف أكثر من 12 مُنظّمًا موضعيًا وجهازيًا لنمو أنسجة العظام، تُؤثّر على إعادة تشكيلها، ومن أبرزها هرمون PTH، و1,25(OH)2D3 ،والكالسيتونين ، وهرمون النمو، والجلوكوكورتيكويدات، وهرمونات الغدة الدرقية، والأنسولين، وIGF (1 و2)، والإستروجينات، وPGE2 ، والأندروجينات.
تُطلق خلايا العظام عددًا من البروتينات والسيتوكينات التي تُنظم الغدد الصماء وتُرسل الإشارات. تشمل البروتينات التي تُنتجها الخلايا البانية للعظم بروتينات مصفوفة العظم، مثل الكولاجين، والأوستيوبونتين، والأوستيوكالسين، وبروتينات سيالوبروتين العظم. بالإضافة إلى ذلك، تُطلق هذه الخلايا البروتيازات، بصورتيها النشطة والكامنة، والتي تُشارك في عملية إعادة تشكيل أنسجة العظم - وهي مكونات نظام مُنشِّط البلازمينوجين (PA)/البلازمين. تعمل السيتوكينات التي تُطلقها الخلايا البانية للعظم من خلال آليات إفرازية ذاتية ومسارات نظيرة إفرازية على الخلايا المحلية (الخلايا البانية للعظم الأخرى، والخلايا الناقضة للعظم).
لم يُعرف بعد ما إذا كانت هذه الإشارات تُنظَّم بواسطة إجهاد ميكانيكي أم إشارات كيميائية أخرى ناتجة عنه. ومع ذلك، من المعروف أن الإجهاد الميكانيكي المتكرر يُسبب تكاثرًا موضعيًا لخلايا العظام و/أو البروتينات. في الجسم الحي، يُمكن أن يُنشِّط التحميل الميكانيكي الخلايا بانيات العظم، ويزيد من مستوى النيوكليوتيدات الحلقية، وإنتاج البروستاجلاندين، ويُسبب تغيرات مورفولوجية مرتبطة بإعادة تشكيل العظام. في المختبر، يُسبب الإجهاد الميكانيكي تكاثر مزارع الخلايا بانيات العظم، والتعبير عن الحمض النووي الريبوزي المرسال (mRNA) لبروتينات العظام المُشاركة في تكوين العظم والتمعدن، وإطلاق عوامل النمو الموضعية مثل عامل النمو الشبيه بالأنسولين (IGF-1) وعامل النمو الشبيه بالأنسولين (IGF-2)، وجزيئات الالتصاق. يُمكن نقل إشارة الإجهاد الميكانيكي عبر قنوات أيونية حساسة للميكانيكا.
هناك أدلة غير مباشرة على خلل في وظيفة الخلايا العظمية في هشاشة العظام. أظهر جي. جيفيرز وجيه. ديكيكر (1987) زيادة في مستويات أوستيوكالسين في المصل لدى النساء المصابات بهشاشة العظام في اليد، وكذلك في غرسات العظام القشرية، مما يشير إلى أن أمراض العظام قد تكون جزءًا من هشاشة العظام. كشف تشريح الجثة ليس فقط عن سماكة العظم تحت الغضروف، ولكن أيضًا عن انخفاض غير طبيعي في تمعدن رأس الفخذ. في خنازير غينيا المصابة بهشاشة العظام المستحثة جراحيًا، كشف التصوير المقطعي المحوسب عن سماكة كبيرة في جزء العظم في المنطقة تحت الغضروفية. يمكن أن يؤدي اختلال التوازن بين بروتينات الكولاجين وغير الكولاجينية (الأوستيوكالسين، إلخ) إلى زيادة في حجم العظام، ولكنه لا يؤثر على كثافتها المعدنية. وفقًا لـ م. شيميزو وآخرون. (1993)، يرتبط تطور التغيرات التنكسية في الغضروف المفصلي بإعادة تشكيل أكثر كثافة للعظم تحت الغضروف وزيادة صلابته، مما يشير أيضًا إلى وجود خلل في خلايا أنسجة العظام في هشاشة العظام. ووفقًا للفرضية التي طرحها ب. لي وم. أسبدن (1997)، فإن تكاثر خلايا العظام المعيبة قد يؤدي إلى زيادة صلابة أنسجة العظام، ولكنه لا يسبب زيادة في كثافتها المعدنية.
افترض سي آي ويستاكوت وآخرون (1997) أن الخلايا البانية للعظم غير الطبيعية تؤثر بشكل مباشر على استقلاب الغضروف. عند زراعة الخلايا البانية للعظم من مرضى مصابين بهشاشة العظام باستخدام خلايا غضروفية من أشخاص غير مصابين بأمراض المفاصل، لاحظ الباحثون تغيرًا ملحوظًا في إطلاق الغليكوز أمينوغليكان من أنسجة الغضروف الطبيعية في المختبر، إلا أن مستوى إطلاق السيتوكين ظل دون تغيير. أظهر جي. هلال وآخرون (1998) أن زراعة الخلايا البانية للعظم من العظم تحت الغضروفي لمرضى مصابين بهشاشة العظام في المختبر شهدت تغيرًا في استقلابها - حيث ارتفع نشاط نظام AP/plasmin ومستوى IGF-1 في هذه الخلايا. يمكن تفسير ملاحظة سي آي ويستاكوت وآخرون (1997) بزيادة نشاط البروتياز في خلايا العظم تحت الغضروف.
لا يزال من غير المعروف ما إذا كانت التغيرات في العظم تحت الغضروفي هي التي تبدأ الفصال العظمي أو تساهم في تطوره. أظهر DK Dedrick وآخرون (1993) أنه في الكلاب المصابة بالفصال العظمي الناجم عن الجراحة، فإن سماكة العظم تحت الغضروفي ليست شرطًا ضروريًا لتطور التغيرات الشبيهة بالفصال العظمي في الغضروف المفصلي، ولكنها تساهم في تطور العمليات التنكسية في الغضروف. تتناقض نتائج الدراسة التي أجراها A. Sa'ied وآخرون (1997) مع بيانات الدراسة السابقة. باستخدام تخطيط صدى القلب بتردد 50 ميجاهرتز لتقييم التغيرات المورفولوجية الأولية وتطورها في الغضروف المفصلي والعظام في الفصال العظمي التجريبي الناجم عن حقن حمض أحادي يودوأسيتيك في مفصل الركبة لدى الفئران، أظهر المؤلفون عملية متزامنة للتغيرات في العظام والغضاريف خلال الأيام الثلاثة الأولى بعد الحقن.
تفرز الخلايا العظمية عوامل النمو والسيتوكينات المشاركة في إعادة تشكيل العظام الموضعية، والتي قد تعزز إعادة تشكيل الغضروف السليم في المفاصل "الحاملة للوزن" بعد اختراقها للشقوق الدقيقة في الطبقة المتكلسة من الغضروف المفصلي. علاوة على ذلك، توجد نواتج إفراز خلايا العظام في السائل الزليلي. ومن المرجح أن تكون المنتجات التي تفرزها الخلايا العظمية غير الطبيعية والتي يمكن أن تبدأ عملية إعادة تشكيل الغضروف الموضعي هي TGF-b وبروتينات مورفومترية العظام (BMPs). يتم إفراز كلا العضوين من عائلة TGF بواسطة كل من الخلايا الغضروفية والخلايا العظمية، وكلاهما قادر على تعديل إعادة تشكيل كل من العظام والغضاريف. لاحظ ج. مارتيل بيليتييه وآخرون (1997) زيادة في مستوى TGF-β في الطعوم العظمية تحت الغضروفية لمرضى هشاشة العظام مقارنة بالأفراد الأصحاء، مما يشير إلى دور محتمل لعامل النمو هذا في التسبب في هشاشة العظام. تُنتج الخلايا العظمية أيضًا عوامل النمو الشبيهة بالأنسولين (IGFs). في مزرعة خلايا شبيهة بالخلايا العظمية، مأخوذة من مرضى مصابين بهشاشة العظام، وُجد ارتفاع في مستوى عوامل النمو الشبيهة بالأنسولين، مما يُغير أيض الغضاريف.
قد تؤثر عوامل تحويل عامل النمو (TGF-b) وعامل النمو الشبيه بالأنسولين (IGF) وبروتينات بناء العظام (BMP) والسيتوكينات التي تنتجها الخلايا البانية للعظم تحت الغضروفي على إنتاج الكولاجيناز وغيره من الإنزيمات المحللة للبروتين في الغضروف، مما قد يعزز بدوره إعادة تشكيل/تحلل مصفوفة الغضروف. لا يزال من غير الواضح ما إذا كانت الخلايا البانية للعظم في هشاشة العظام تُنتج عامل تحفيز مستعمرات البلاعم (M-CSF - وهو مُحفز لامتصاص العظم) أقل من الخلايا الطبيعية. أظهرت نتائج دراسات أجراها إيه جي أوتيرليندن وآخرون (1997) أن مستقبلات فيتامين د، التي تُعبر عنها الخلايا البانية للعظم وتنظم التعبير عن عدد من العوامل التي تُنتجها هذه الخلايا، قد تلعب دورًا في تكوين النتوءات العظمية، مما يُفسر جزئيًا دور الخلايا البانية للعظم في التسبب في هذا المرض.
مع الأخذ بعين الاعتبار نتائج الدراسات المذكورة أعلاه، اقترح ج. هلال وآخرون (1998) وج. مارتيل-بيليتييه وآخرون (1997) الفرضية العملية التالية للعلاقة بين إعادة تشكيل العظم تحت الغضروف والغضروف المفصلي السليم في هشاشة العظام. في مرحلة مبكرة أو متقدمة من مرض هشاشة العظام، تشتد عملية إعادة تشكيل أنسجة العظام في العظم تحت الغضروف. في الوقت نفسه، يؤدي التحميل المتكرر إلى كسور دقيقة موضعية و/أو ظهور خلل في نظام عامل النمو الشبيه بالأنسولين/بروتين ربط عامل النمو الشبيه بالأنسولين (IGFBP) بسبب استجابة غير طبيعية لخلايا بناء العظم تحت الغضروف، مما يساهم في تصلبها. يمكن أن يساهم هذا الأخير بدوره في ظهور كسور دقيقة في الغضروف السليم وتلف مصفوفته.
في الظروف العادية، يُصلح هذا الضرر عن طريق التخليق والإفراز الموضعي لـ IGF-1 وبروتين ربط IGF، مما يُحفز تكوين المصفوفة خارج الخلوية للغضروف المفصلي. في الوقت نفسه، يُعزز نظام GF نمو خلايا العظام تحت الغضروف وتكوين مصفوفة العظام. يزداد النشاط الابتنائي لنظام IGF في العظم تحت الغضروف لدى مرضى الفصال العظمي، بينما يُسبب التنشيط الموضعي لنظام AP/البلازمين (منظم موضعي لنظام IGF) في الغضروف المفصلي تغيراته الموضعية. في الخلايا العظمية المُصابة بالفصال العظمي، يُعطل IGF-1 تنظيم AP بواسطة البلازمين من خلال التغذية الراجعة الإيجابية، وبالتالي، يُمكنه كبح إعادة تشكيل أنسجة العظام، مما يؤدي في النهاية إلى التصلب تحت الغضروفي. وهكذا، في أنسجة العظام والغضاريف، يؤدي التحفيز الموضعي لـ IGF-1 والبروتيازات، من جهة، إلى تلف الغضروف، ومن جهة أخرى، إلى سماكة العظم تحت الغضروف، وهذا الأخير بدوره يُسهم في مزيد من تلف الغضروف. يؤدي اختلال التوازن بين تلف الغضروف المرتبط بالتصلب تحت الغضروفي وقدراته الإصلاحية إلى تغيرات تدريجية في المصفوفة خارج الخلوية للغضروف، وإلى تطور هشاشة العظام. ووفقًا للباحثين، تُفسر هذه الفرضية أيضًا التطور البطيء للمرض.

