ضمور العضلات الشوكي
آخر مراجعة: 07.06.2024

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
ضمور العضلات الشوكي ليس وحدة أنيوولوجية واحدة ، ولكنها مجموعة كاملة من الأمراض الوراثية غير المتجانسة سريريًا وراثيًا التي تثيرها عمليات تنكس الخلايا العصبية في القرون الشوكية الأمامية. يشتمل المصطلح على متغيرات مختلفة من شلل الجسدية المحيطي وضمرا عضليًا محددًا وراثياً ناتجة عن انحطاط الخلايا العصبية الحركية الشوكية و/أو جذع الدماغ. السبب الأكثر شيوعًا للمشكلة هو طفرة متنحية ذاتية على الكتف الطويل من الكروموسوم الخامس. العلاج غير محدد ، يهدف إلى تحسين تدهور الأنسجة العصبية وتوفير الدعم التلطيفي لتحسين نوعية الحياة. [1]
علم الأوبئة
يحدث ضمور عضلي في العمود الفقري في حالة واحدة لكل 6000 إلى 10،000 من الأطفال حديثي الولادة (وفقًا للمجلة الأمريكية لعلم الوراثة الطبية 2002).
انتشار ناقلات SMN Gene Exon 7 الحذف هو 1:50 شخصًا.
يحدث ضمور عضلي بلو سكوي (متلازمة كينيدي) في طفل واحد في 50000 وهو نوع البالغين الأكثر شيوعًا من النخبة الشوكية.
تجدر الإشارة إلى أن نصف الأطفال المصابين بهذا المرض لا يتغلبون على فترة البقاء لمدة عامين.
ويرث علم الأمراض وفقا للمبدأ المتنحي التلقائي. في أغلب الأحيان ، يكون كل والد لطفل مريض حامل نسخة واحدة من الجين المتحور. نظرًا لأن الطفرة يتم تعويضها من خلال وجود نسخة جينية "طبيعية" ثانية ، فإن الوالدين ليس لديهم مظاهر للضمور العضلي الشوكي. عادة ما لا يرث علم الأمراض 2 نسخة إضافية من الوالد. تحدث المشكلة بسبب الفشل العرضي أثناء تكوين الخلايا الجرثومية ، أو مباشرة في وقت الإخصاب. مع ضمور العضلات الشوكي من النوع الأول ، يحدث التطور التلقائي للمرض في 2 ٪ فقط من الحالات (في هذه الحالة ، الناقل هو واحد فقط من الوالدين). [2]
الأسباب ضمور العضلات الشوكي
السبب الرئيسي لضمور العضلات الفقرية هو طفرة للجين المسؤول عن إنتاج بروتين SMN المترجمة على الكروموسوم 5Q. يؤدي هذا الاضطراب إلى الوفاة التدريجية للخلايا العصبية الحركية في القرون الأمامية للحبل الشوكي وجذع الدماغ. نتيجة لهذه العمليات ، تتطور نغمة قطرات العضلات ، وتتطور ضمور العضلات التنفسية والبلعوم والوجه والهيكل العظمي. النوع السائد من ميراث الأشكال عند الأطفال من ضمور العضلات الشوكي هو متنقلة تلقائية ، مما يعني أن حمل الجينات المعيبة من قبل كلا الوالدين. أما بالنسبة لعلم أمراض النوع الرابع (شكل البالغين) ، فهناك رابط للكروموسوم X ، لذلك يتأثر الذكور فقط.
يعتمد تطور ضمور العضلات الفقرية على العمليات المتزايدة للانحطاط وموت الخلايا العصبية الحركية في القرون الأمامية العمود الفقري ، وتلف نوى جذع الدماغ. التغيرات المرضية هي الأكثر كثافة في مناطق سماكة عنق الرحم والقطني. يتم تقليل العدد الخلوي إلى الحد الأدنى ، ويحدث الاستبدال عن طريق الأنسجة الضامة ، والذي يرجع إلى فشل برنامج موت الخلية - ما يسمى موت الخلايا المبرمج. يؤثر التغيير على هياكل نوى المحرك للأعصاب القحفية ، والجذور الأمامية ، والأعصاب الحركية. هناك عيادة من ضمور اللفات العصبي. مع مسار طويل من المرض في مرحلة متأخرة من النمو الزائد للأنسجة الضامة يحدث.
يرتبط ظهور الصورة السريرية المقابلة بنقص بروتين SMN ، والذي يؤثر على الوظيفة الناجحة للخلايا العصبية الحركية في القرون الشوكية الأمامية. تم اكتشاف نقص البروتين كواحد من الروابط في تطور ضمور العضلات الشوكي في نهاية القرن العاشر. على خلفية أضرار الخلايا العصبية ، فإن تعصيب العضلات الهيكلية (أقسام قريبة بشكل أساسي) يعاني من ضعف. [3]
عوامل الخطر
يتم تفسير تنوع الأشكال السريرية للضمور العضلي الشوكي 5Q من خلال وجود بعض العوامل المعدلة التي يمكن تقسيمها إلى فئتين: تلك التي تؤثر وتلك التي لا تؤثر على درجة بروتين SMN.
- حاليًا ، يعتبر جين SMN2 هو العامل الأساسي في تطور ضمور العضلات الشوكي: كلما زادت نسخ جين SMN2 ، انخفضت شدة أعراض المرض. العامل الثاني ، الذي يرتبط مباشرة بالنسخة المركزية من جين SMN ، هو استبدال 1 nucleotide c.859g & gt ؛ c في exon 7 من جين SMN2 ، مما يؤدي إلى تشكيل موقع لصق مرتبط بالمرتبط الجديد: والنتيجة هي إدراج exon 7 في النسخ من جين SMN2. يرتبط هذا الاختلاف بزيادة مستوى الدم من بروتين SMN كامل الطول في المرضى الذين يعانون من النخبة الشوكية من النوع الثاني أو الثالث.
عوامل أخرى تؤثر على عدد SMNS:
- العوامل التنظيمية الربط (TRA2β - يستحث تخطي exon من exon 7 ، SF2/ASF - يزيد من إدراج exon 7 ، HNRNPA1 - قمع exon 7 إدراج جين SMN2).
- العوامل التنظيمية للنسخ (CREB1 - يزيد من نسخ SMN ، STAT3 - يفضل نمو محور عصبي ، IRF1 - يزيد من عدد SMN ، PRL - يزيد من العمر في المراحل الشديدة).
- عوامل استقرار مرنا (U1A تنقل SMN ، HUR/P38).
- العوامل التي تؤثر على تعديل ما بعد الترويج (RCA - قمع تدهور SMN ، GSK3 - يزيد من البقاء على قيد الحياة).
- العوامل الخارجية (الجوع ، نقص الأكسجة ، الإجهاد التأكسدي).
تم تحديد آثار العوامل المذكورة أعلاه في الغالب في المختبر.
- العوامل التي لا ترتبط بجين SMN-على وجه الخصوص ، البروتينات التي تعمل على تحسين التسمم الداخلي في المشابك العصبية (Laminin 3 ، كورونين ، دلتا العصبية ، البروتين الشبيه بالكرول الكالسيوم).
يتم إيلاء اهتمام إضافي إلى مثيلة الحمض النووي ، وهو التعديل الأكثر استقرارًا الذي يؤثر على طبيعة التعبير الجيني. تم العثور على مثيلة مجموعة من الجينات التي ربما تشارك في العمليات المسببة للأمراض ترتبط مع شدة ضمور العضلات الشوكية. [4]
طريقة تطور المرض
ضمور العضلات الشوكي هو علم أمراض وراثي يكون له أي من أنواع الميراث - كل من المهيمنة التلقائية والحيوية المتنحية أو المرتبطة بـ X - متأصلة. في معظم الأحيان نتحدث عن علم الأمراض المتنحي الذاتي في مرحلة الطفولة المبكرة. مسؤولية تشكيل مثل هذه النخاع الشوكي هي الجين SMN ، المترجمة في موضع 5Q13. يؤدي حذف exon 7 في جين SMN إلى علم الأمراض بمشاركة محتملة للجينات القريبة P44 و NAIP.
يقوم جينوم SNM بترميز بروتين يتضمن 294 من الأحماض الأمينية ويحتوي على ملم حوالي 38 كيلو دالتون. البروتين له الوظائف التالية:
- هو جزء من مجمع بروتين الحمض النووي الريبي.
- يشارك في تكوين موقع spliceosome الذي يحفز الربط قبل الحمض النووي الريبي ؛
- تشارك في العمليات التي تتحكم في إنتاج البروتين وإسويات البروتين ؛
- يوفر النقل المحوري من مرنا.
- يفضل نمو الخلايا العصبية ويوفر التواصل العصبي العضلي.
يُعرف نوعان من جينات SMN:
- Telomeric SMNT (SMN1) ؛
- Centromeric SMNC (SMN2).
الغالبية العظمى من حالات الضمور العضلي الشوكي ترجع إلى تغييرات في جين SMN1.
يوجد في كينيدي ضمور العضلات الشوكي ارتباطًا بموضع XQ12 الذي يحتوي على جين NR3C3 ، والذي يشفر بروتين مستقبلات الأندروجين. لديها متغير الميراث المرتبط X. عندما يتكرر عدد CAG في جين واحد Exon ، يتطور علم الأمراض.
يرافق قمع إنتاج بروتين SNM التغييرات التالية:
- بسبب ضعف تنسيق محور عصبي ، يحدث التفرع المفرط للمحاور ؛
- يتباطأ نمو المحاور العصبية وانخفاض حجمها ؛
- هناك تجميع غير لائق لقنوات الكالسيوم في مخروط النمو.
- تتشكل المحطات غير المنتظمة مسبقات من محاور خلايا العصب الحركي.
يبدأ الحبل الشوكي بفقدان الخلايا العصبية الحركية بنشاط في القرون الأمامية ، مما يفسر تطور ضمور عضلات الأطراف القريبة. [5]
الأعراض ضمور العضلات الشوكي
غالبًا ما تظهر أعراض ضمور العضلات الشوكي في الغالب في الغالب في فترة المولود الجديد وما يصل إلى ستة أشهر ، تتجلى في متلازمة طفل "بطيء". يلاحظ الصدر على شكل جرس ، ونقص النقش المكثف ، ونقص ردود الفعل ، وترجمة العضلات من اللسان والضيق التنفسي. يموت الرضع المرضى في كثير من الأحيان قبل أن يصلوا إلى سنتين: النتيجة المميتة ترجع إلى زيادة فشل الجهاز التنفسي على خلفية الالتزام بالعمليات المعدية.
تم اكتشاف الشكل الوسيط للضمور العضلي الشوكي من النوع الثاني من سن ستة أشهر. بالإضافة إلى متلازمة الطفل "البطيء" ، هناك انخفاض في ضغط الدم ، والافتقار إلى ردود الفعل ، واضطرابات الجهاز التنفسي ، وترجمة اللسان. حتى لو كان الأطفال قادرين على الجلوس ، فإن تقلصات متعددة للمفاصل الكبيرة تتطور.
يبدأ ضمور Kugelberg-Wielander العضلي الشوكي أيضًا في مرحلة الطفولة المبكرة ، مع تمكن الأطفال من التحرك بشكل مستقل. هناك إضعاف من الحرقفي ، عضلات الفخذ وعضلات المقاومات ، انخفاض ضغط الدم ، انخفاض ردود الفعل وترجمة اللسان. يفقد العديد من المرضى القدرة على التحرك (المشي) بشكل مستقل على مر السنين.
يبدأ ضمور العضلات الفقري من النوع 4 في سن أكبر. ويتميز بطيئة التقدم والتشخيص الحميد نسبيا. [6]
يتجلى ضمور كينيدي في أغلب الأحيان في منتصف العمر (عمومًا قد لاول مرة في المرضى من 15 إلى 60 سنة). تشمل الأعراض وجع العضلات والضعف ، والتوليد ، والضعف البعيدة ، والخمول ، وترجمة اللسان وضمور. توجد علامات خلل وظيفي في المصباح:
- صعوبة البلع.
- الطموح
- إضعاف العضلات المضغية ؛
- خلل الحركة
- الهزات الوضعية والحركية في اليدين.
العلامات الأولى لنقص الأندروجين:
- التثدي (في حوالي 60 ٪ من المرضى) ، وغالبا ما يكون غير متماثل ؛
- تدهور الوظيفة الجنسية (oligospermia ، ضمور الخصية ، ضعف الانتصاب).
العلامات الأولى
يتجلى النخبة الشوكية عن طريق ضعف العضلات والعجز العام. جميع القدرات الحسية والفكرية لا تتأثر.
المؤشرات الرئيسية لعلم الأمراض العصبي العضلي:
- ويلاحظ العضلات "كسول" ، ضعيفة ، التراخي وعضلات العضلات ؛
- نغمة العضلات منخفضة ، يتم تقليل ردود الفعل الأوتار إلى الحد الأدنى أو غائبة ؛
- ردود الفعل الطبيعية أو الغائبة.
- ويلاحظ ارتعاشات قصيرة من مجموعات العضلات الفردية (يمكن رؤيتها تحت الجلد ، على اللسان) ؛
- هناك علامات ضمور العضلات.
يتجلى متلازمة Werdnig-Hoffman من خلال نقص التوتر الوضوح للعضلات ، والخمول العام ، وعدم قدرة الطفل على حمل الرأس ، والتقلب والجلوس. عند محاولة دعم الطفل في منطقة البطن في حالة مع وقف التنفيذ ، يبدو أن الجسم "يتراجع". إن السعال والبلع والفكين المصاب غير مرضٍ ، وغالبًا ما يدخل الطعام في الجهاز التنفسي ، فإن التنفس يمثل مشكلة. قد يكون هناك تشويه مفصل يرتبط بنقص التوتر داخل الرحم. غالبًا ما تشير المعلومات المخلوطة التي تم جمعها أثناء الحمل إلى انخفاض نشاط الجنين.
العلامات الأساسية لضمور العضلات الفقري من النوع الأول:
- التخلف الشديد في التنمية الحركية ؛
- بداية سريعة من الانقباضات المشتركة والانحناء الصدري ؛
- زيادة اضطرابات الجهاز التنفسي والمصباح ، ومشاكل في البلع (كل من الغذاء واللعاب) واضطراب البلغم ؛
- زيادة خطر التهاب الطموح ؛
- العدوى ، فشل الجهاز التنفسي التدريجي.
يتجلى ضمور العضلات الشوكي من النوع الثاني عن طريق تثبيط واضح للتطور الحركي. على الرغم من أن العديد من المرضى يمكنهم الجلوس دون مساعدة ، وحتى في بعض الأحيان الزحف والوقوف ، غالبًا ما تضيع هذه القدرات مع مرور الوقت. ويلاحظ اهتزازات الإصبع ، وتشوهات العضلات والمفصل (العظام) ، ومشاكل الجهاز التنفسي. من المحتمل العجل الزائف.
الميزات الرئيسية لعلم الأمراض من النوع الثاني:
- التأخير التنموي ، بما في ذلك إيقاف وعكس تطوير المهارات والقدرات المكتسبة بالفعل ؛
- زيادة ضعف العضلات الوربية ؛
- السطحية من التنفس الحاجز ، ضعف انعكاس السعال ، تفاقم تدريجي لفشل الجهاز التنفسي ؛
- انحناء الصدر والعمود الشوكي ، الانقباضات.
في متلازمة Kugelberg-Wielander ، تكون المظاهر أكثر اعتدالًا ، وتتقدم ببطء. المريض قادر على التحرك ، ولكن هناك مشاكل في الركض أو تسلق السلالم. غالبًا ما تشمل الأعراض المتأخرة صعوبة في البلع والمضغ.
يكشف ضمور العضلات الشوكي من النوع الرابع عن نفسه بالفعل في العمر الأقدم (البالغ) ويتميز بدورة "معتدلة" ومواتية. العلامات الرئيسية: فقدان تدريجي للقدرة على التحرك. [7]
إستمارات
يعد ضمور العضلات الشوكي جزءًا من مجموعة من الأمراض الوراثية التي تتميز بالتغيرات التنكسية ، وموت الخلايا العصبية الحركية للقرون الشوكية الأمامية ، وغالبًا ما تكون نواة محرك جذع الدماغ. يمكن أن تجعل هذه العملية نفسها معروفة في فترات حياة مختلفة ، فإن الصورة السريرية ليست هي نفسها دائمًا. قد تختلف أنواع الميراث والدورة.
تم وصف ضمور العضلات الشوكي للأطفال لأول مرة في أواخر القرن التاسع عشر. في منتصف القرن العشرين ، تم تحديد الأشكال الرئيسية للمرض:
- الخلقية (يتجلى مباشرة بعد ولادة الرضيع) ؛
- الشكل الطفولي المبكر (يحدث على خلفية التطور الطبيعي السابق للطفل) ؛
- شكل الطفولة المتأخرة (يكشف عن نفسه ابتداء من سن 2 وما فوق).
يجمع بعض المتخصصين بين النماذج الثانية والثالثة في نوع واحد من طبقة الأطفال من النخاع الشوكي.
من المقبول عمومًا تقسيم علم الأمراض إلى طب الأطفال والبالغين. يتم تصنيف ضمور العضلات الشوكي عند الأطفال في وقت مبكر (مع ظهور لاول مرة في الأشهر القليلة الأولى بعد ولادة الطفل) ، المتأخر والمراهق (المراهق ، أو الأحداث). المتلازمات الأكثر شيوعًا هي:
- ضمور Werdnig-Hoffman ؛
- شكل Kugelberg-Wielander ؛
- ضمور العضلات الشوكي المزمن المزمن.
- متلازمة Vialetto-Van Lare (نوع البثور الهوائي مع عدم وجود السمع) ؛
- متلازمة فازيو-لوند.
لاول مرة ضمور العضلات الشوكية البالغة على مدار 16 عامًا وحتى سن 60 عامًا تقريبًا ، تتميز بعيادة حميدة نسبيًا وتشخيصًا. تشمل أمراض البالغين:
- ضمور كينيدي البهائي.
- ضمور scapuloperoneal.
- أشكال الوجه لطف وأشكال Oculo-pharyngeal ؛
- ضمور العمود الفقري البعيد.
- ضمور العمود الفقري أحادي.
منفصل بشكل منفصل مع عزل وضمور العمود الفقري. يتميز علم الأمراض المعزول بهبة الأضرار التي لحقت بالخلايا العصبية الحركية الشوكية (والتي هي في كثير من الأحيان العلامة الوحيدة للمشكلة). علم الأمراض المشترك نادر ويمثل مجمعًا من الاضطرابات العصبية والجسدية. هناك أوصاف لحالات المتلازمة المشتركة مع التشوهات التاجية الخلقية ، والافتقار إلى الوظيفة السمعية ، أوليجوفرينيا ، ونقص التنس المخيخ.
يتم تمثيل ضمور العضلات الشوكي لدى كبار السن بشكل شائع من خلال أموتو كينيدي بلبوسبالي. هذا الأمراض ورث المرتبط بعملية. مسار المرض بطيء ، حميد نسبيا. يبدأ مع ضمور العضلات القريبة للأطراف السفلية. الهزة المحتملة من اليدين ، الرأس. في الوقت نفسه ، يتم الكشف عن مشاكل الغدد الصماء أيضًا: ضمور الخصية ، التثدي ، مرض السكري. على الرغم من ذلك ، في البالغين ، يستمر علم الأمراض في شكل أكثر اعتدالا من الأطفال.
متغير من ضمور العضلات الشوكي. |
لاول مرة في علم الأمراض |
مشكلة يمكن اكتشافها |
عمر الوفاة |
الأعراض المميزة |
ضمور عضلي العمود الفقري من النوع 1 (اسم آخر ضمور عضلي في الشوكة الشوكية) |
من الولادة إلى ستة أشهر |
لا يستطيع الطفل الجلوس |
ما يصل إلى عامين |
ضعف العضلات الشديد ، نقص التوتر ، مشكلة في التمسك بالثقب ، والكبالة والسعال ، والبلع ومشاكل اللعاب ، وتطوير الفشل التنفسي والطموح الالتهاب الرئوي |
ضمور العضلات الفقري من النوع 2 |
ستة أشهر إلى سنة ونصف |
لا يستطيع الطفل الوقوف |
أكثر من عامين |
تأخير المحرك ، نقص الوزن ، ضعف السعال ، الهزات اليدوية ، انحناء العمود الفقري ، الانقباضات |
ضمور العضلات الشوكي النوع 3 (اسم آخر Kugelberg-Welander ضمور العضلات الشوكي) |
بعد سنة ونصف. |
يمكن أن يقف في البداية والمشي ، ولكن في عصر معين قد تضيع هذه القدرة |
في مرحلة البلوغ. |
ضعف العضلات ، الانقباضات ، فرط الحركة المشتركة |
ضمور عضلي العمود الفقري النوع 4. |
المراهقة أو مرحلة البلوغ |
يمكن أن يقف في البداية والمشي ، ولكن في عصر معين قد تضيع هذه القدرة |
في مرحلة البلوغ. |
زيادة ضعف العضلات القريبة ، انخفاض ردود أفعال الأوتار ، واردة العضلات (اللفات) |
يقال حول ضمور العمود الفقري البعيد في حالة آفات الخلايا العصبية الحركية للحبل الشوكي ، الذي يعصب الجزء السفلي من الجسم. علامات مميزة لهذه الأمراض هي:
- ضمور عضلات الفخذ.
- الضعف في الركبتين ، البسطية القدم ، وعضلات مقرن الورك.
لا تغيير في ردود الفعل الأوتار.
يتم تمثيل ضمور العضلات الشوكي البعيدة عن طريق اختلافين أليليين مع النمط الظاهري المتداخل:
- ضمور العضلات الشوكي الفريواني الفريني.
- اعتلال الأعصاب الحسي الوراثي من نوع 2C charcot-marie-tooth.
يتميز الضمور العضلي الشوكي القريب 5Q بزيادة أعراض الشلل الرخوي وضمور العضلات ، وهو بسبب التغيرات التنكسية في الخلايا العصبية الحركية ألفا من القرون الشوكية الأمامية. مرض خلقي مع اختناق ما بعد الولادة هو أشد أشكال: منذ اللحظة التي يولد فيها الطفل ، يكون النشاط الحركي غائبًا عملياً ، وهناك تقلصات ، ابتلاع ومشاكل في الجهاز التنفسي. في معظم الحالات ، يموت هذا الطفل.
المضاعفات والنتائج
يؤدي مزيد من التقدم من النخبة الشوكية إلى ضعف وتقليل كتلة العضلات من الأطراف (وخاصة الساقين). لا يفقد الطفل في البداية أو يفقد تدريجياً المهارات المكتسبة - أي يفقد القدرة على المشي والجلوس دون دعم. يتناقص النشاط الحركي للأطراف العلوية ، وتصبح المفاصل قاسية ، ويتم إرفاق الانقباضات بمرور الوقت ، ويصبح العمود الفقري منحنيًا.
من أجل الحفاظ على القدرات الحركية لأطول فترة ممكنة ومنع تطور المضاعفات ، يوصى به:
- ممارسة وضعية الجسم الصحيح (موضع مضاد للجاذبية) ، سواء في السرير وعند الجلوس ، المشي ، إلخ.. ؛
- العلاج الطبيعي المنتظم ، تمارين التمدد ، التدليك ، العلاج الطبيعي ، بغض النظر عن نوع ضمور عضلي العمود الفقري ؛
- استخدم أسرة خاصة وكراسي (كراسي متحركة) ، مراتب ووسائد ؛
- تحديد واستخدام تقويم العظام الداعم ، الكورسيهات ؛
- ممارسة العلاج المائي والعلاج الحجري ، الذي له تأثير إيجابي على الجهاز التنفسي والعضلي الهيكلي والجهاز الهضمي ، الجهاز العصبي والأوعية الدموية ؛
- إجراء فحوصات تشخيصية منتظمة ، بما في ذلك الاختبارات السريرية ، الصور الشعاعية في العمود الفقري والحوض ؛
- التشاور بشكل منهجي مع أخصائي العلاج الطبيعي وجراحة العظام مع خبرة في العمل مع مرضى مماثل ؛
- اضبط الكورسيهات ، العظام ، الأجهزة العظمية ، الكراسي المتحركة ، إلخ. اعتمادًا على الديناميات.
يجب التعرف على مقدمي الرعاية لمريض يعاني من ضمور عضلي في العمود الفقري:
- مع أساسيات السلوك الآمن ، والعلاج الطبيعي ، والتدليك ، والعلاج الطبيعي ؛
- مع قواعد الحفاظ على النشاط المستقل للمريض ، استخدام الأجهزة العظمية ؛
- مع قواعد الرعاية ، النظافة.
غالبًا ما يكون النخبة الشوكية معقدة بسبب ضعف المضغ والبلع والتوصيل للأغذية ، مما يهدد الطموح وتطور التهاب الطموح للرئتين أو انسداد الجهاز التنفسي ، وهو الأكثر تميزًا في علم الأمراض من النوع الأول. يتضح من مشاكل البلع من خلال أعراض مثل إطالة كبيرة ومستمرة لفترة الأكل ، والتردد في تناول الطعام ، والطعام الذي يسقط من الفم ، والمسافة العادية ، وتفاقم الوزن.
تكشف اضطرابات حركية الجهاز الهضمي عن نفسها ، والضعف التمعجي ، والبقاء المطول للطعام في المعدة (ركود المعدة) ، وتطور الجزر المعدي المريئي. من أجل منع مثل هذه المضاعفات ، من الضروري:
- مراقبة الموضع الصحيح للمريض أثناء تناول الطعام ؛
- إذا لزم الأمر ، استخدم أنبوب المعدة أو فغر المعدة لضمان تناول السوائل والمغذيات الكافية وتقليل خطر الطموح ؛
- الالتزام بقواعد إعداد الطعام والشراب ، وشاهد اتساقها ، وتواتر الوجبات ؛
- اعتمادًا على وصفة الطبيب ، استخدم الأدوية ، التدليك ، العلاج الطبيعي ، إلخ.
واحدة من أخطر مضاعفات النخبة الشوكية هي خلل الجهاز التنفسي المرتبط بضعف عضلات الجهاز التنفسي. يمكن أن تكون اضطرابات الجهاز التنفسي قاتلة ، سواء عند الرضع الذين يعانون من أمراض النوع الأول أو في مرضى المراهقين والبالغين الذين يعانون من مرض النوع 2 أو 3. المشاكل الرئيسية هي كما يلي:
- إن رد الفعل السعال منزعج ، وهناك مشاكل في انتهاء البلغم من الجهاز التنفسي ؛
- زيادة العجز في حجم الهواء الذي يدخل الرئتين ، وإفراز ثاني أكسيد الكربون من الرئتين ؛
- يشوه الصدر ، ويضغط ويشوه الرئتين.
- العمليات المعدية في شكل الالتهاب الرئوي.
لمنع مثل هذه المضاعفات ، غالبًا ما ينصح المرضى بأداء تمارين التنفس باستخدام حقيبة AMBU. [9]
التشخيص ضمور العضلات الشوكي
في المرضى الذين يعانون من الاشتباه في العمود الفقري ، تكون التحقيقات مثل هذه القيمة التشخيصية:
- كيمياء الدم
- تحليل الحمض النووي الوراثي.
- Electroneuromyography.
من بين الطرق الإضافية ، من الممكن تعيين خزعة من ألياف العضلات والموجات فوق الصوتية والتصوير بالرنين للعضلات والدماغ.
قد تشير اختبارات الدم إلى أن فوسفوكيناز الكرياتين طبيعي من الناحية الفسيولوجية ، ولكن في بعض الحالات قد يتم رفعه إلى حوالي 2.5 مرة.
الكهربية الكهربية تكشف عن تغيرات بسبب فقدان الخلايا العصبية في العمود الفقري الحركي. يتم اكتشاف ذلك من خلال انخفاض في سعة منحنى التداخل ، حدوث إمكانات نشطة تلقائية ، والتي هي أبحاث وربطات تشكل "إيقاع تردد" محدد. تكون سرعة إشارة الاندفاع التي تمر عبر ألياف المحرك الطرفية طبيعية أو انخفضت بسبب اضطرابات الترن الثانوية. [10]
غالبًا ما يتم تمثيل التشخيص الفعال أيضًا بالموجات فوق الصوتية أو التصوير بالرنين المغناطيسي للعضلات ، مما يسمح باكتشاف استبدال العضلات عن طريق الأنسجة الدهنية. يكشف التصوير بالرنين المغناطيسي عن نمط عملية مرضي نموذجي فريد من نوعه للضمور العضلي الشوكي. ومع ذلك ، هذا ممكن فقط في المراحل المتأخرة من الآفة.
في سياق التحليل المورفولوجي لخزعة العضلات في المرضى ، يتم تحديد صورة غير محددة في شكل ضمور الحزمة وتجميع ألياف العضلات. ينتمي العدد الساحق من ألياف العضلات المصابة إلى النوع 1 ، والخصائص المناعية والكيميائية ضمن الحدود الطبيعية. صورة البنية التحتية غير محددة.
الإجراء التشخيصي الأكثر أهمية لضمور العضلات الشوكي المشتبه به هو اختبار يمكن أن يكتشف طفرة الجين SMN. من خلال تحليل الحمض النووي المباشر ، من الممكن اكتشاف وجود أو عدم وجود exons السابع والثامن من جينات SMNC و SMNT. الطريقة الأكثر إفادة هي التحليل الكمي ، والتي يمكن أن تحدد رقم نسخة الجينات وتوضيح شكل ضمور عضلي العمود الفقري. الطريقة الكمية مهمة أيضًا في تقييم حالة المريض. إنه مقياس ضروري يتم إجراؤه لغرض المزيد من الاستشارة العائلية الطبية والوراثية.
يتم إجراء اختبارات تشخيصية إضافية فقط بعد الحصول على نتيجة سلبية لحذف الجين SMN. إذا كان الكشف عن طفرات النقطة مطلوبًا ، فقد يتم استخدام التسلسل الآلي المباشر لجين SMNT.
تشخيص متباين
يتم إجراء التشخيص التفاضلي مع العمليات المرضية التي تكشف عن مجمع أعراض "المريض البطيء" ، مع ضمور العضلات الخلقية ، الاعتلال العضلي الهيكلي أو الميتوكوندريا. على وجه الخصوص ، يجب استبعاد وجود مثل هذه الأمراض:
- مرض الخلايا العصبية الحركية ؛
- تصلب عضلي الجانبي الأولي.
- ضمور العضلات.
- اعتلال عضلات الأعضاء الخلقية.
- الأمراض المرتبطة بتراكم الجليكوجين ؛
- شلل الأطفال؛
- المناعة الذاتية الوهن العضلي.
تم تطوير خوارزمية التشخيص اعتمادًا على خصوصيات الأعراض لدى طفل معين. وبالتالي ، يتم استخدام تصنيف خاص للمرضى ، اعتمادًا على الحالة الوظيفية (علاج Europrotocol NMD):
- غير قادر على الجلوس دون دعم (طريح الفراش).
- قادرة على الجلوس ولكن غير قادر على المشي (المستقرة).
- قادرة على التحرك بشكل مستقل (المشي المرضى).
يوصى بالخوارزمية التشخيصية التالية للمرضى في المجموعة الأولى:
- الفحص البدني (اكتشاف انحناء الصدر ، وتقييم وظيفة الجهاز التنفسي والسعال ، وحالة الجلد) ؛
- مراقبة القلب والجهاز التنفسي ، polysomnography ، وتحديد أعراض العجز في التهوية الرئوية ؛
- مقياس تأكسج النبض لتحديد درجة الأكسجين ؛
- تقييم تواتر أمراض الالتهابات المعدية ودورات المضادات الحيوية خلال فترة الستة أشهر المتطرفة ؛
- الأشعة السينية الصدر مع دراسات ديناميات التكرار ؛
- تقييم وظيفة البلع.
للمرضى في المجموعة الثانية ، تنطبق الخوارزمية التالية:
- الفحص البدني
- مراقبة القلب والجهاز التنفسي ، polysomnography للكشف عن عجز التهوية الرئوية ؛
- مقياس تأكسج النبض
- تقييم تواتر العمليات الالتهابية المعدية ودورات المضادات الحيوية خلال فترة الستة أشهر المتطرفة ؛
- فحص العمود الفقري ، الأشعة السينية للعمود الفقري ، تقييم درجة الانحناء.
يشار إلى المرضى في المجموعة الثالثة لمثل هذه الدراسات:
- الفحص البدني
- اختبار وظيفة الجهاز التنفسي (يشمل قياس التنفس ، وحساب حجم الرئة ، وتقييم وظيفة العضلات التنفسية) ؛
- لمعرفة تواتر أمراض الالتهابات المعدية ودورات المضادات الحيوية خلال الفترة السنوية المتطرفة.
قد تكون ممارسة التشخيص التفاضلي معقدة من خلال تشابه جينات SMN1 و SMN2. لتجنب الأخطاء ، يوصى باستخدام طريقة MLPA ، والتي تسمح بالكشف عن عدد نسخ Exon 7 في جين SMN1.
في معظم حالات ضمور العضلات الشوكي ، هناك حذف متماثل من exon 7 و/أو 8 في جين SMN1. ومع ذلك ، يمكن أن تكون الجينات الأخرى (ATP7A ، DCTN1 ، UBA1 ، BSCL2 ، EXOSC3 ، GARS ، إلخ) "المذنبين" ، والتي ينبغي الانتباه إلى ما إذا كان اختبار SMN1 سلبيًا.
يمكن أن تكون المواد الحيوية للدراسة هي الدم المحيطي أو دم الجنين ، وخرائط بقعة الدم الجافة. التشخيص إلزامي:
- في وجود تاريخ مشدد من ضمور العضلات الشوكي ؛
- عندما يتم اكتشاف أعراض مشبوهة ، بغض النظر عن التاريخ الوراثي.
بالإضافة إلى ذلك ، يوصى أيضًا بالبحث لجميع الأزواج المسؤولين في التخطيط للحمل.
من الاتصال؟
علاج او معاملة ضمور العضلات الشوكي
يحتاج المرضى الذين يعانون من ضمور عضلي في العمود الفقري إلى علاج شامل يشمل:
- الرعاية ، والمساعدة ، والدعم ؛
- الغذاء الغذائي
- العلاج الدوائي
- تدابير إعادة تأهيل عدم التدخل ، بما في ذلك العلاج الحجري والعلاج الطبيعي.
نظام علاجي يتضمن تأثيرًا متعددًا على جميع أنظمة الجسم ، وليس فقط الجهاز العضلي الهيكلي ، هو المعيار.
لسوء الحظ ، من المستحيل علاج ضمور العضلات الشوكي بشكل جذري. ولكن غالبًا ما يكون من الممكن تحسين نوعية حياة المريض من خلال الاستخدام المختص للأحماض الأمينية ومجمعات الفيتامينات المتعددة ، وعوامل التغذية العصبية ، وحاصرات قنوات الكالسيوم ، وموسعات الأوعية ، والأدوية القلبية والخلوية ، ومثبطات البروتياز ، والأدوية الستيرويدية ، ومضادات الأكسدة ، والمناعة المناعية ، لقد ثبت تجريبياً أن العلاج بالخلايا الجذعية ، والمركبات العصبية ، وجزيئات تعزيز العضلات يمكن أن تؤدي إلى اضطرابات جهازية لا يمكن التنبؤ بها. في الوقت نفسه ، لم يتم إثبات ديناميات إيجابية بعد تطبيق هذا العلاج حتى الآن.
نظرًا لأن المشكلة ناتجة عن نقص بروتين SMN الطبيعي ، يمكن تحسين المرضى عن طريق زيادة مستويات بروتين SMN بنسبة 25 ٪ أو أكثر. لهذا السبب ، يتم البحث في الأدوية التي يمكن أن تنشط إنتاج هذا البروتين بنشاط ، بما في ذلك Gabapentin و Riluzole و Hydroxyurea و Albuterol و Valproic Acid و Sodium Phenylbutyrate.
يوفر الطب الحديث أيضًا علاجًا جراحيًا للضمور العضلي الشوكي. وهو يتألف من محاذاة جراحية للعمود الفقري - تصحيح الانحناء العصبي العضلي. يقوم الجراحون بتثبيت متعدد المستويات للعمود الفقري ، باستخدام الإنشاءات الخاصة. يتم استخدام العجز والحوض والفقرات من الصدر العلوي أو الفقرات الأخرى كنقاط دعم. تساعد الجراحة على محاذاة العمود الشوكي ، وتوزيع الحمل عليه بالتساوي ، والقضاء على عدم الراحة عند تغيير موضع الجسم ، وتجنب الآثار الضارة على الأعضاء الداخلية (بما في ذلك الرئتين).
الأدوية
حاليًا ، لا يوجد علاج مسبب للضمور العضلي الشوكي: يستمر الطب العلمي في العمل في هذه المهمة. في السابق ، نجح العلماء بالفعل في عزل الأدوية التي يمكن أن تعزز إنتاج مرنا من جين SMN2. لكن التجارب السريرية الدولية الواسعة النطاق التي تنطوي على الأشخاص الذين يعانون من ضمور عضلي في العمود الفقري لم تتم بعد.
معظم الأدوية المدرجة في نظام العلاج القياسي لها مبدأ عام للعمل مع أدلة منخفضة نسبيا على الفعالية.
L-Carnitine |
حمض أميني يحدث بشكل طبيعي ، "نسبي" لفيتامينات مجموعة B. يتم إنتاجه في الجسم ، موجود في عضلات الكبد والعرضية المخططة ، ينتمي إلى عدد من المواد الشبيهة بالفيتامينات. يشارك في عمليات التمثيل الغذائي ، ويدعم نشاط COA ، يستخدم لتطبيع التمثيل الغذائي. إنه يحتوي على قدرة الابتنائية ومضادات الغدة الدرقية ومضادة السمية ، ويحفز استقلاب الدهون وإصلاح الأنسجة ، ويؤدي إلى تحسين الشهية. يوصف L-Carnitine بمقدار حوالي 1 ألف ملغ يوميًا. يمكن أن يستمر مسار العلاج لمدة تصل إلى شهرين. |
أنزيم Q10 (يوبيكوينون) |
مجموعة البنزيم البنزوكينون التي تحتوي على عدد من مجموعات الأيزوبرينيل. هذه هي الأنزيمات القابلة للذوبان في الدهون ، والتي توجد أساسا في الميتوكوندريا من الهياكل الخلوية حقيقية النواة. يتم تضمين يوبيكوينون في سلسلة نقل الإلكترون ، ويشارك في الفسفرة المؤكسدة. تم العثور على أعظم وجود للمادة في الأعضاء الغنية بالطاقة - على وجه الخصوص ، في الكبد والقلب. من بين أمور أخرى ، يمكن للإنزيم Q10 له خصائص مضادة للأكسدة ، ويمكنه استعادة سعة مضادات الأكسدة من ألفا توكوفيرول. عادة ما يتم وصفها من 30 إلى 90 ملغ من الدواء يوميًا ، وهو مسار لمدة شهرين. |
المخيين |
دواء nootropic مع خصائص التغذية العصبية. غالبًا ما يتم استخدامه في الأنظمة العلاجية لعلاج الأمراض العصبية ، بما في ذلك الخرف الوعائي ، والسكتة الدماغية. يتضمن الكسر النشط الببتيدات ذات الوزن الجزيئي المحدد من 10 آلاف الدالتون. يتم إعطاء الدواء كحقن عن طريق الوريد من 1-2 مل. يتكون مسار العلاج من 10-15 حقن. |
Actovegin |
ويمثل تكوين الدواء بببتيدات الوزن الجزيئي منخفضة ومشتقات الأحماض الأمينية. Actovegin هو غلبة العدوى: يتم عزلها بواسطة غسيل الكلى مع الترشيح الفائق. بفضل استخدام الدواء ، يتم زيادة امتصاص واستخدام الأكسجين ، يتم تسريع استقلاب الطاقة. يستخدم الدواء في شكل حقن عن طريق الوريد من 1-2 مل ، وتتطلب الدورة 10-15 حقن. |
Solcoseryl |
إنه غسيل غسيل الكلى القادر على تحسين الأكسجين قبل الخلوية ونقل الجلوكوز ، مما يعزز إنتاج ATP داخل الخلايا ، وتحفيز تفاعلات الأنسجة المتجددة ، وتنشيط تكاثر الخلايا الليفية وإنتاج الكنيسة في الجدران الوعائية. يتكون مسار العلاج من 10-15 حقن عضلية من الدواء (1-2 مل يوميا). |
Neuromultivit (مجمع فيتامين ب) |
الفيتامينات المتعددة ، تستخدم بنشاط في نقص فيتامينات ب. غالبًا ما يكون بديلاً عن جودة حقن استعدادات الفيتامينات. ينشط عمليات التمثيل الغذائي في الدماغ ، ويعزز استعادة أنسجة الجهاز العصبي ، له تأثير مسكن. Neuromultivit تأخذ 1-2 أقراص يوميا ، مسار 4 أو 8 أسابيع. |
فيتامين ه |
مضادات الأكسدة المعروفة ، فيتامين قابلة للذوبان في الدهون. يوصف في دورات من 1-2 أشهر بمبلغ 10-20 وحدة دولية يوميًا. |
فالبرات |
لديهم نشاط مهدئ ومريح ، ويظهران قدرة مضادات الاختلاج ، وزيادة مستوى GABA في الجهاز العصبي المركزي. تستخدم فقط لعلاج الأطفال على مدى سنة واحدة ، من 10 إلى 20 ملغ لكل كيلوغرام في اليوم. |
سالبوتامول |
موسع القصبات ، الذي ينتمي إلى مجموعة من ناهضات مستقبلات BETA2 المنقولة الانتقائية. يؤدي الاستخدام المنتظم للدواء إلى زيادة إنتاج الرنا المرسال وبروتين SMN ، والذي يؤثر بشكل إيجابي على الصورة السريرية لضمور العضلات الشوكي. يتم استخدام Salbutamol بحذر ، 2-4 ملغ أربع مرات في اليوم (الحد الأقصى للمبلغ هو 32 ملغ في اليوم). |
واحدة من أحدث الأدوية المستخدمة في ضمور العضلات الشوكي هو Zolgensma zolgensma zolgensma ، مما يضمن النشاط والوظيفة الصحيحة للخلايا العصبية الحركية المنقولة. يتم إعطاء الدواء بالاشتراك مع الأدوية المناعية وفقًا لبروتوكول خاص ويتم إعطاؤه مرة واحدة عن طريق الوريد ، استنادًا إلى جرعة اسمية من 1.1 ͯ 1014VG/kg (يتم تحديد الحجم الإجمالي للإدارة اعتمادًا على وزن المريض).
قبل بدء علاج Zolgensma ، من الضروري تحديد مستوى الأجسام المضادة لـ AAV9 باستخدام طريقة تشخيصية معتمدة ، وتقييم الوظيفة الكبدية (ALT ، AST ، البيليروبين الكلي) ، وإجراء فحص الدم السريري العام واختبار التروبونين I ، تحديد مستوى الكرياتينين. إذا تم اكتشاف الظروف المعدية النشطة الحادة والمزمنة ، يتم تأجيل إدارة الدواء حتى علاج أو الانتهاء من مرحلة الانتكاس للعملية المعدية.
يعتبر التأثير الجانبي الأكثر شيوعًا للدواء هو فشل الكبد ، والذي يمكن أن يكون قاتلاً.
الأدوية الأخرى المعتمدة التي قد يصفها طبيبك لضمور العضلات الشوكية:
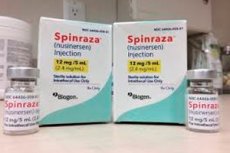
- Spinraza هو تحضير لصوديوم Nusinersen ، وهو أليغنوكليوتيد مضاد للناشئ مصمم خصيصًا لعلاج الأموتر الفقري. ويهدف إلى الإدارة داخل القمامة عن طريق ثقب القطني. الجرعة الموصى بها هي 12 ملغ. يتم تحديد نظام العلاج من قبل الطبيب المعالج.
- Risdiplam هو دواء يعدل الربط بين سلائف مرنا للبقاء على قيد الحياة من الخلية العصبية الجين 2. يتم أخذ Risdiplam عن طريق الفم ، مرة واحدة في اليوم. يتم تحديد الجرعة من قبل الطبيب بشكل فردي ، مع مراعاة عمر المريض ووزنه. إن استخدام الدواء لدى الأطفال الذين تقل أعمارهم عن شهرين هو بطلان. ويلاحظ سمية الجنينية لهذا الدواء ، لذلك يجب على المرضى الذين يعانون من الإمكانية الإنجابية اتخاذ تدابير منع الحمل دقيقة خلال فترة وبعضها بعد العلاج.
علاج العلاج الطبيعي لضمور العضلات الشوكية
يستخدم العلاج الطبيعي كواحد من روابط العلاج المعقد وإعادة تأهيل المرضى الذين يعانون من ضمور عضلي في العمود الفقري. النقاط الرئيسية لهذه العلاج هي:
- استخدام التفريغ عن طريق أنظمة التعليق ، والتدريب النشط ، واستخدام التحفيز الكهربائي عن طريق الجلد للحبل الشوكي ؛
- تمارين التنفس والعلاج الطبيعي ؛
- جلسات العمودية لمدة نصف ساعة.
- علاجات التحفيز الكهرمائي (جلسات مدتها 20 دقيقة ، جنبًا إلى جنب مع تمارين لتحسين المهارات الحركية الدقيقة) ؛
- التقنيات اليدوية
- تطبيقات البارافين على مجموعات مختلفة من التعبيرات ؛
- دارسونفال لتحسين أداء العضلات.
تعتمد طريقة darsonvalization على التأثير على الأنسجة باستخدام تيار نبض التردد العالي المتناوب من الجهد العالي والقوة المنخفضة. بعد مسار من الإجراءات ، هناك زيادة في أداء العضلات ، وتعزيز الأوعية الدقيقة ، وتوسيع الشرايين والشعيرات الدموية ، والقضاء على نقص التروية ، وتحسين التغذية وإمدادات الأكسجين بالعضلات ، والتي لها تأثير إيجابي على مجرى العمليات المتجاورة والشربية.
واحدة من أهم المشكلات في المرضى الذين يعانون من النخبة الشوكية هو ضعف العضلات في الجهاز التنفسي ، وغالبًا ما يؤدي إلى خلل في الجهاز التنفسي وموت المريض.
في النخبة الشوكية ، فإن العضلات الهيكلية بأكملها ، بما في ذلك المسؤول عن التنفس ، يعاني من ضعف الأداء. يؤثر الضعف وضمور العضلات التدريجي سلبًا على جودة قانون الجهاز التنفسي ، ويؤدي إلى تطور المضاعفات وزيادة فشل الجهاز التنفسي. لذلك ، من الضروري اتخاذ تدابير لتعزيز العضلات ، والوقاية من مضاعفات الجهاز التنفسي والتهابات الجهاز التنفسي. دور خاص في هذا يلعب الجمباز مع حقيبة AMBU ، والتي يتم تنفيذها بالتزامن مع العلاج الطبيعي ، تمارين التمدد ، التدليك. يتيح لك استخدام حقيبة AMBU "توسيع" حجم الصدر والرئتين. بالنسبة لأنشطة الأطفال هي حقيبة مناسبة مع حجم واحد على الأقل لتر واحد ونصف ، مزود بصمام لإطلاق ضغط مفرط (لمنع باروتراوما).
لا ينبغي إجراء التمارين على معدة كاملة. وضع الجسم - الجلوس ، شبه متخلف ، مستلقي على الجانب أو الخلف (إذا لم تكن هناك مشاكل مع البلغم): من الأمثل إجراء الإجراءات في مواقع مختلفة في كل مرة. من المهم أن يتم تقويم ظهر المريض. إذا لزم الأمر ، يتم استخدام مشد. قبل بدء الإجراء ، تأكد من أن مجرى الهواء خالي من البلغم.
تدليك للضمور العضلي الشوكي
يجب أن يكون التدليك لعلاج الأميوتات الفقرية خفيفًا ولطيفًا. في مناطق المقاومة العضلية ، تطبق الآثار العامة ، بما في ذلك التنصت ، وفي مناطق التعصيب المحفوظة ، استخدم التمسيد العميق (الطولي ، العرضي) ، العجن.
بشكل عام ، ممارسة أنواع مختلفة من التدليك ، اعتمادًا على الخصائص الفردية لمسار المرض ، عصر المريض. هذه يمكن أن تكون:
- العجن لتحفيز العضلات العميقة.
- فرك لتحسين الدورة الدموية للدم والليمفاوية.
- المعالجة الفورية لنقاط الزناد ؛
- من قصف تقوية الألياف.
من المهم أن ينتشر التأثير على منطقة المشكلة بأكملها.
موانع للتدليك لضمور العضلات الشوكي:
- الالتهاب الحاد ، ارتفاع درجة حرارة الجسم ؛
- اضطرابات الدم ، ميول النزيف ؛
- العمليات السيئة ؛
- الأمراض الجلدية الفطرية المعدية ؛
- تمدد الأوعية الدموية الوعائية ، التهاب الخثر ، التهاب البطانة ، التهاب اللمفاوية ؛
- الأورام الحميدة والخبيثة.
يوصف مسار أي تدليك للمريض المصاب بضمور العضلات الفقرية بشكل فردي. السلوك غير السليم للإجراء ، يمكن أن يضر تأثير المريض بشكل مفرط وغير الصحيح بحالة المريض.
الوقاية
يتم الآن متابعة تشخيص الحمض النووي المباشر وغير المباشر وتشخيص الحمض النووي قبل الولادة. هذا يقلل بشكل كبير من احتمال ولاد طفل مريض ، وهو أمر مهم بشكل خاص للأزواج الذين عانوا بالفعل من ولادة الأطفال الذين يعانون من ضمور عضلي في العمود الفقري.
تمثل التدابير الوقائية اتجاهًا طبيًا مهمًا ويتم تصنيفها في تدابير أولية وثانوية وثانوية.
تهدف التدابير الأولية إلى منع تأثير عامل غير موات مباشرة ومنع تطور المرض. يتكون هذا الوقاية من تصحيح النظام الغذائي والنظام اليومي ، مما يؤدي إلى نمط حياة صحي.
تتمثل الوقاية الثانوية في القضاء على عوامل الخطر الواضحة وتشمل التشخيص المبكر للأمراض ، وإنشاء المراقبة في الديناميات ، والعلاج الموجهة.
يتم الوقاية من التعليم العالي فيما يتعلق بشخص مريض محروم من بعض القدرات الحركية. في هذه الحالة ، نتحدث عن الأدوية والنفسية والاجتماعية والعمل.
وفقًا للمعلومات من منظمة الصحة العالمية ، يولد أكثر من 2 ٪ من الأطفال في العالم بنوع من الاضطراب التنموي. في الوقت نفسه ، 0.5-1 ٪ من هذه الاضطرابات من أصل وراثي. يتم تقليل الوقاية من هذه المشكلات إلى الاستشارة الوراثية الطبية والتشخيص قبل الولادة ، مما يسمح بالتقليل من مخاطر الولادة للطفل مع أمراض وراثية.
يعتمد خطر الشخص في الحصول على ضمور عضلي في العمود الفقري أو أي مرض وراثي آخر على الجينات الموروثة من والدته ووالده. التحديد المبكر للعوامل الوراثية ، يمكن أن يسمى حساب المخاطر الفردية لعلم الأمراض المحدد وراثيا وسيلة للوقاية المستهدفة.
تتضمن مقاييس التشخيص قبل الولادة طرق البحث المباشرة وغير المباشرة. في البداية ، يتم تحديد النساء اللائي يحتاجن إلى تشخيص ما قبل الولادة غير المباشر. قد تشمل هذه:
- النساء الحوامل 35 سنة وما فوق.
- الذين خضعوا 2 أو أكثر من الإجهاض التلقائي السابق ؛
- الذين لديهم أطفال يعانون من عيوب تنموية وراثية ؛
- مع تاريخ وراثي غير موات.
- الذين تعرضوا للالتهابات الفيروسية أو التعرض للإشعاع (بما في ذلك خلال مرحلة التخطيط للحمل).
لأغراض وقائية ، يتم استخدام طرق مثل الموجات فوق الصوتية والاختبارات الهرمونية (الفحص الكيميائي الحيوي). في بعض الأحيان ، يتم استخدام الإجراءات الغازية مثل chorionbiopsy ، والبسطي ، والتشكيل المشيمي ، والتكوين cordocentesis. تتيح لك معلومات موثوقة حول المخاطر الوراثية ضبط نمط حياتك وحملك لمنع ولادة طفل مريض.
لقاح ضمور عضلي في العمود الفقري
بالطبع ، يرغب جميع أولياء أمور الأطفال المصابين بالميوتروفي في العمود الفقري في علاجهم تمامًا من المرض. ومع ذلك ، لا يوجد لقاح يمكنه القضاء على المشكلة. على الرغم من أن البحث في تحسين العلاج مستمر.
على وجه الخصوص ، في عام 2016 ، وافق العلماء الأمريكيون على الدواء الفريد من نوعه (Nusinersen) ، والذي تمت الموافقة عليه لاحقًا للاستخدام في البلدان الأوروبية.
يحقق المتخصصون في مشكلة معالجة ضمور العضلات الشوكي بهذه الطرق:
- إصلاح أو استبدال جين SMN1 "الخطأ" ؛
- تعزيز وظيفة الجين SMN2 الطبيعي.
- حماية الخلايا العصبية الحركية المتأثرة بسبب نقص بروتين SMN ؛
- حماية العضلات من التغيرات الضمورية لمنع أو استعادة الوظيفة المفقودة على خلفية تطور علم الأمراض.
يتضمن العلاج الجيني استهداف الجين التالف باستخدام ناقلات فيروسية تمر عبر غشاء الدم في الدماغ والوصول إلى المنطقة المناسبة في الحبل الشوكي. ثم يصيب الفيروس "الخلية المتأثرة مع جزء من الحمض النووي الصحي ، كما لو أن" خياطة "عيب الجين. وبالتالي ، يتم تصحيح وظيفة الخلايا العصبية الحركية.
اتجاه آخر هو علاج جزيء صغير ، جوهره هو تعزيز وظيفة الجين SMN2. لدى الرضع الذين يعانون من ضمور عضلي في العمود الفقري المشخص نسخة واحدة على الأقل من جين SMN2. تم البحث في هذا الاتجاه بنشاط من قبل العلماء الأميركيين ، وفي الوقت الحالي العديد من الأدوية التي تهدف إلى تعزيز توليف البروتين الكامل من جين SMN2 يخضعون لتجارب سريرية.
وسيلة أخرى من التدخل العلاجي المحتمل هي استكشاف الحماية العصبية للحد من موت الخلايا العصبية الحركية ، وزيادة قدرتها التكيفية وتحسين وظائفها.
الاتجاه الثالث ينطوي على حماية العضلات من العمليات الضمورية. نظرًا لأن نقص بروتين SMN يؤثر سلبًا على خلايا الأعصاب الحركية ووظيفة العضلات ، يجب أن يكون الهدف من هذا العلاج هو حماية العضلات من الضمور ، وزيادة كتلة العضلات ، واستعادة وظيفة العضلات. لن يؤثر هذا النوع من العلاج على الجهاز الوراثي ، لكنه قد يتباطأ أو حتى يمنع تفاقم ضمور العضلات الشوكي.
فحص للضمور العضلي الشوكي
يستخدم فحص المواليد الجدد بشكل متزايد في الممارسة الطبية وغالبًا ما يلعب دورًا حاسمًا. يمكن أن يؤدي اكتشاف ضمور عضلي في العمود الفقري في أقرب وقت ممكن إلى تحسين تشخيص الطفل المريض بشكل كبير. يشمل تشخيص الفحص النقاط التالية الموضحة في الجدول:
شكل من أشكال ضمور العضلات الشوكية |
الأعراض |
ضمور العضلات الشوكي من النوع الأول (لا يمكن للطفل الجلوس ، متوسط العمر المتوقع - حتى عامين) |
يظهر نفسه منذ الولادة حتى سن ستة أشهر. يتم الكشف عن نغمة العضلات غير الكافية ، والبكاء ضعيف ، ويزيد ضعف العضلات (بما في ذلك العضلات المضغ والبلع). هناك مشاكل في احتباس الرأس ، يفترض الطفل وضع "الضفدع" عند الاستلقاء. |
من النوع الثاني لضمور العضلات الشوكية (الطفل قادر على الجلوس ، وعادة ما يكون متوسط العمر المتوقع أكثر من عامين ، ويعيش أكثر من نصف المرضى من 20 إلى 25 عامًا) |
لاول مرة تبدأ من 7 أشهر من العمر وما يصل إلى سنة ونصف من العمر. في بعض الأحيان يلاحظ في بعض الأحيان البلع والجهاز التنفسي والسعال. تشمل العلامات الدائمة تشنجات العضلات ، حركية مفصل محدودة ، انحناء العمود الفقري ، انخفاض ضغط الدم وضعف العضلات. |
ضمور العضلات الشوكي من النوع الثالث (يمكن للطفل الجلوس والتحرك ، لكن القدرات المذكورة أعلاه تضيع تدريجياً ، متوسط العمر المتوقع أمر طبيعي) |
لاول مرة في سن سنة ونصف. انحناء العمود الفقري والصدر ، وضمور عضلي الحوض والساقين القريبة ، وزيادة حركة المفاصل. البلع صعب. |
ضمور العضلات الفقري من النوع الرابع |
يشير إلى شكل البالغين. الأعراض تشترك في الكثير مع وجود ضمور عضلي العمود الفقري من النوع الثالث. يزداد الضعف تدريجياً ، وتظهر الهزات والفماء العضلي مع ظهورها في سن 16-25 سنة. |
توقعات
في متلازمة Werdnig-Hoffman ، يبلغ متوسط العمر المتوقع 1.5-2 سنة. النتيجة المميتة في معظم الحالات ترجع إلى زيادة فشل الجهاز التنفسي وتطور الالتهاب في الرئتين. مع الدعم التنفسي في الوقت المناسب في شكل تهوية اصطناعية ، من الممكن زيادة متوسط العمر المتوقع للطفل. هناك حاجة خاصة للرعاية الملطفة المستمرة ، والتي مطلوبة أيضًا في النمط الأميوتروفي من النوع الثاني. تتميز أمراض الأنواع الثالثة والرابعة بتكهن أكثر ملاءمة.
أي نوع من ضمور العضلات الشوكي هو مرض خطير. يحتاج جميع أفراد أسرة المريض إلى دعم نفسي وإعلامي واجتماعي مستمر. من المهم للمريض ضمان التشخيص الكافي والدعم المهني من أخصائيين مثل طبيب الأطفال ، أخصائي الأعصاب ، أخصائي الأعصاب ، أخصائي أمراض القلب ، أخصائي أمراض القلب ، أخصائي العظام ، أخصائي العلاج الطبيعي ، إلخ.
يتم منح العديد من المرضى إعاقة ، ويتم وضع خطة لإعادة التأهيل الفردية.
بطبيعة الحال ، يحدث ضمور عضلي في العمود الفقري دون استخدام معدات خاصة لدعم التنفس والتغذية في حوالي نصف الحالات ينتهي في وفاة الطفل المريض قبل سن عامين (معظمهم من النوع الأول).

