خبير طبي في المقال
منشورات جديدة
النماذج التجريبية لالتهاب المفاصل العظمي المفصلي
آخر مراجعة: 07.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
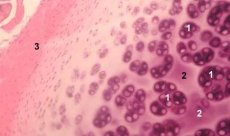
الغضروف نسيجٌ شديد التخصص، يحتوي على نوعٍ واحدٍ فقط من الخلايا (الخلايا الغضروفية)، ويتميز بغياب الأوعية الدموية واللمفاوية. يتغذى الغضروف بشكلٍ رئيسيٍّ عن طريق الامتصاص من السائل الزليلي. يُنظَّم أيض الخلايا الغضروفية بواسطة عددٍ من العوامل القابلة للذوبان التي تُنتِجها الخلايا الغضروفية والأنسجة المحيطة بها موضعيًا. تعتمد وظيفة الخلايا الغضروفية أيضًا على تركيبة البيئة خارج الخلوية (توتر الأكسجين، وتركيز الأيونات، ودرجة الحموضة، وما إلى ذلك)، وتركيب المصفوفة خارج الخلوية، وتفاعل الخلايا مع المصفوفة، والإشارات الفيزيائية. الهدف الرئيسي من النمذجة التجريبية هو إنشاء مزارع في البيئة خارج الخلوية دون تغيير النمط الظاهري للخلايا الناضجة. الهدف الثاني هو إنشاء مزارع لدراسة استجابة الخلايا الغضروفية المبكرة، أو المتأخرة، أو قصيرة المدى، أو المطولة للإشارات الكيميائية و/أو الفيزيائية. كما تُتيح الدراسات المختبرية فرصةً لدراسة سلوك الخلايا الغضروفية في هشاشة العظام. الهدف الثالث هو تطوير أنظمة زراعة مشتركة تُتيح دراسة تفاعلات الأنسجة المختلفة في المفصل. المهمة الرابعة هي تحضير غرسات الغضروف للزراعة اللاحقة. وأخيرًا، المهمة الخامسة هي دراسة عوامل النمو، أو السيتوكينات، أو العوامل العلاجية القادرة على تحفيز إصلاح الغضروف و/أو تثبيط امتصاصه.
على مدى العقود الماضية، طُوّرت نماذج مختلفة لمزارع خلايا الغضروف المفصلي، بما في ذلك المزارع أحادية الطبقة، والمزارع المُعلّقة، ومزارع الغضروف، والطعوم، والمزارع المُشتركة، ومزارع الخلايا الخالدة. لكلّ مزرعة مزاياها وعيوبها، وكلّ منها مناسب لدراسة جانب مُحدّد من جوانب أيض الخلايا الغضروفية. لذا، تُعدّ طعوم الغضروف نموذجًا ممتازًا لدراسة دوران عناصر المصفوفة، الأمر الذي يتطلّب مُستقبلات سطحية خلوية حقيقية وتفاعلات طبيعية بين الخلايا والمصفوفة والمصفوفة. في الوقت نفسه، يُوصى بدراسة رواسب المصفوفة أو الآليات المُنظّمة لأيض الخلايا الغضروفية في مزرعة خلايا معزولة. تُعدُّ مزرعة أحادية الطبقة منخفضة الكثافة ضرورية لدراسة عملية تمايز الخلايا. تُمثّل المزارع المُعلّقة في مصفوفة طبيعية أو اصطناعية نموذجًا لتحليل الاستجابة التكيفية للخلايا الغضروفية للإجهاد الميكانيكي.
مزارع الخلايا الغضروفية
يجب مراعاة عدة نقاط مهمة عند اختيار أنسجة الغضاريف للدراسات المختبرية. يختلف تركيب المصفوفة والنشاط الأيضي للخلايا الغضروفية باختلاف المفاصل، ويعتمد هذا الأخير أيضًا على عمق موقع الخلايا الغضروفية في النسيج. تم الحصول على هذه البيانات من عدة تجارب دُرست فيها مجموعات فرعية من الخلايا الغضروفية المعزولة من مناطق غضروفية ذات أعماق مختلفة. وُجد عدد من الاختلافات المورفولوجية والكيميائية الحيوية بين الخلايا الغضروفية المزروعة الموجودة في الطبقات السطحية والعميقة من الغضروف المفصلي. تُنتج الخلايا السطحية مصفوفة ليفية متفرقة وفقيرة بالبروتيوغليكان، بينما تُنتج الخلايا العميقة مصفوفة غنية بالألياف والبروتيوغليكان. علاوة على ذلك، تُنتج الخلايا السطحية كمية أكبر نسبيًا من البروتيوغليكان غير المتجمع وحمض الهيالورونيك، وكمية أقل نسبيًا من الأجريكان وكبريتات الكيراتان مقارنةً بالخلايا الغضروفية العميقة. من السمات المميزة المهمة الأخرى لاستقلاب الخلايا الغضروفية المعزولة من مناطق غضروفية مختلفة الأعماق الاستجابة لمحفز خارجي. ووفقًا لم. أيدلوت وآخرون، كانت الخلايا الغضروفية البقرية من المنطقة السطحية للغضروف أكثر حساسيةً للإنترلوكين-1 مقارنةً بالخلايا من المنطقة العميقة.
يعتمد سلوك الخلية أيضًا على موقع الأنسجة. تستجيب الخلايا الغضروفية من غضروف الضلع والأذن من نفس الحيوان بشكل مختلف لعوامل النمو مثل عامل نمو الخلايا الليفية (FGF) وTGF-beta. زاد FGF من دمج الثيميدين والبرولين والليوسين في غضروف الضلع المزروع ولكن ليس في غضروف الأذن. زاد TGF-beta من دمج الثيميدين في غضروف الضلع والأذن ولكن لم يكن له تأثير على دمج الثيميدين والبرولين في غضروف الأذن. تختلف خلايا الغضروف من مناطق الضغط العالي عن تلك الموجودة في مناطق الضغط المنخفض على الغضروف. وبالتالي، فإن غضروف غضروف مفصل ركبة الأغنام الناضجة من المنطقة المركزية للسطح المفصلي لعظم الظنبوب غير المغطى بالغضروف الهلالي، والذي يتحمل أكبر حمل في الجسم الحي، يصنع أجريكان أقل، ولكن ديكورين أكثر من الخلايا من المناطق التي يغطيها الغضروف الهلالي. ويؤكد المؤلفون أيضًا على أهمية استخدام الغضاريف من مناطق المفاصل المتطابقة عند دراسة الوظيفة الاصطناعية للمفاصل.
يعتمد أيض الخلايا الغضروفية واستجابتها للعوامل التنظيمية بشكل كبير على عمر المتبرع وتطور هيكله العظمي وحالة المفاصل التي تؤخذ منها الخلايا. في الخلايا الغضروفية البشرية، يُلاحظ انخفاض كبير في الاستجابة التكاثرية مع التقدم في السن. يُلاحظ أكبر انخفاض لدى المتبرعين الذين تتراوح أعمارهم بين 40 و50 عامًا والذين تزيد أعمارهم عن 60 عامًا. علاوة على ذلك، تنخفض شدة الاستجابة التكاثرية لعوامل النمو (مثل FGF وTGF-beta) مع التقدم في السن. بالإضافة إلى التغيرات الكمية في تكاثر الخلايا الغضروفية، هناك أيضًا تغيرات نوعية. تستجيب خلايا المتبرعين الشباب (10-20 عامًا) بشكل أفضل لعامل النمو المشتق من الصفائح الدموية (PDGF) مقارنةً بعامل النمو المشتق من الصفائح الدموية (TGF-beta)، بينما يُلاحظ العكس في خلايا المتبرعين البالغين. تُستخدم العديد من الآليات لتفسير التغيرات المرتبطة بالعمر في الوظيفة التركيبية للخلايا الغضروفية واستجابتها لعوامل النمو. وتشمل هذه التغيرات انخفاضًا في عدد وتقارب مستقبلات الخلايا السطحية، وتغيرات في تركيب ونشاط عوامل النمو والسيتوكينات، وتعديل إشارات ما بعد المستقبلات.
تُغيّر الحالة المرضية للمفاصل أيضًا مورفولوجيا الخلايا الغضروفية ونشاطها الأيضي. وهكذا، حدد ج. كوري وآخرون (1996) ثلاث مجموعات فرعية من الخلايا الغضروفية في الغضروف المصاب بهشاشة العظام. تُشكّل الخلايا الغضروفية من الجزء السطحي والعلوي من منتصف الغضروف مجموعات وتُصنّع كمية أكبر من البروتيوغليكان والكولاجين. يستطيع عامل النمو المُحوّل بيتا (TGF-beta) وعامل النمو الشبيه بالأنسولين (IGF) تحفيز تخليق البروتيوغليكان بواسطة الخلايا الغضروفية، ويُحيّدان جزئيًا تأثيرات IL-1 وTNF-a. تُعدّ غرسات الغضروف المُصاب بهشاشة العظام والخلايا الغضروفية المعزولة من غضروف مريض مصاب بهشاشة العظام أكثر حساسية لتحفيز عامل النمو المُحوّل بيتا (TGF-beta) من الخلايا الغضروفية السليمة. من المرجح أن ترتبط هذه الاختلافات بالتغيرات الظاهرية في الخلايا الغضروفية في الطبقات العليا من الغضروف المفصلي.
يتم عزل الخلايا الغضروفية الفردية عن طريق المعالجة المتسلسلة للمصفوفة خارج الخلوية (ECM) باستخدام إنزيمات مُحللة للبروتين. بعد إطلاقها من المصفوفة خارج الخلوية، تُعدّ الخلايا المعزولة مثالية لدراسة التركيب الجديد لمكونات المصفوفة. يستخدم بعض الباحثين الكولاجيناز المطثي فقط، بينما يُحضّن آخرون الغضروف مسبقًا باستخدام التربسين، والبروناز، والديناز، و/أو الهيالورونيداز. يعتمد عدد الخلايا المعزولة على الإنزيمات المستخدمة. لذلك، عند المعالجة بالكولاجيناز وحده، يمكن الحصول على 1.4-10 6 خلايا غضروفية من 1 غرام من الأنسجة، بينما باستخدام البروناز، والهيالورونيداز، والكولاجيناز - 4.3-106. عند المعالجة بالكولاجيناز، تبقى الأغريكان، والبروتينات، والإنترلوكين-6، والإنترلوكين-8 في مزرعة الخلايا بكميات أكبر بكثير مقارنةً بالمعالجة المتسلسلة بإنزيمات مختلفة. هناك عدة تفسيرات لهذه الاختلافات بين مزارع الخلايا:
- تُتلف مستقبلات الخلايا أو تُثبّط بواسطة الإنزيمات، ويُثبّط عامل التحويل التحوّلي بيتا تخليق الحمض النووي والبروتيوغليكان في الخلايا الغضروفية المعزولة حديثًا (اليوم الأول)، بينما يُحفّز عامل التحويل التحوّلي بيتا تخليق الحمض النووي والبروتيوغليكان في الخلايا الغضروفية المزروعة في طبقة أحادية (7 أيام). ومع ذلك، يلزم فترة كافية لإعادة التعبير عن هذه المكونات الغشائية قبل بدء التجربة.
- يمكن للبروتيازات الخارجية أن تُعطّل تفاعل الخلية مع المصفوفة بوساطة الإنترجرين. تُعزّز عائلة الإنترجرين ارتباط الخلايا الغضروفية بجزيئات ECM (Shakibaei M. et al., 1997). يمكن أن يؤثر هذا التعطيل على التعبير عن جينات المصفوفة.
- يمكن لبقايا مكونات المصفوفة تنظيم الوظيفة التركيبية للخلايا الغضروفية. تستطيع الإنتجرينات التعرف على نواتج تحلل ECM، وبالتالي تلعب دورًا مهمًا في إصلاح الأنسجة بعد عمل الإنزيمات المحللة للبروتين. أفاد T. Larsson et al. (1989) أن إضافة البروتيوغليكان السليم أو المجزأ إلى مزرعة الخلايا يحفز تخليق البروتينات والبروتيوغليكان. ومع ذلك، فإن المستوى العالي من حمض الهيالورونيك يسبب انخفاضًا كبيرًا في إدراج الكبريتات في تخليق البروتيوغليكان بواسطة الخلايا الغضروفية لجنين الدجاج والخلايا الغضروفية الناضجة لخلايا ساركوما الغضروف لدى الخنازير والجرذان. علاوة على ذلك، فإن حمض الهيالورونيك هو مثبط لإطلاق البروتيوغليكان من الخلايا حتى في وجود IL-1b وTNF-a وFGF، مما يشير إلى مواجهة النشاط البيولوجي الأول لعوامل النمو والسيتوكينات. لا تزال الآلية الدقيقة الكامنة وراء عمل حمض الهيالورونيك غير واضحة؛ من المعروف أن الخلايا الغضروفية تحتوي على مستقبل لحمض الهيالورونيك مرتبط بخيوط الأكتين في السيتوزول. يُحفز ارتباط حمض الهيالورونيك بمستقبله فسفرة البروتينات. وبالتالي، تُظهر هذه البيانات تعديل الوظيفة الأيضية للخلايا الغضروفية بواسطة جزيئات بروتينات المصفوفة المجزأة أو الأصلية من خلال تنشيط مستقبلات غشاء الخلية.
- قد يكون التحفيز السريع لتخليق بروتين المصفوفة بواسطة الخلايا الغضروفية بواسطة الإنزيمات نتيجة لتغيرات في شكل الخلايا الغضروفية و/أو إعادة تنظيم الهيكل الخلوي.
- تُخزَّن بعض السيتوكينات (مثل IL-8) وعوامل النمو (مثل IGF-1 وTGF-β) في المصفوفة خارج الخلوية. وأشهر مثال على ذلك هو ارتباط TGF-β بالديكورين، مما يُؤدي إلى انخفاض قدرة الأولى على تحفيز نمو الخلايا في خلايا مبيض الهامستر الصيني. وتشير نتائج ازدياد محتوى الديكورين في الغضروف مع التقدم في السن إلى انخفاض التوافر الحيوي لـ TGF-β مع التقدم في السن. قد تُطلَق عوامل النمو والسيتوكينات من بقايا المصفوفة أثناء الزراعة، مما يُؤثِّر لاحقًا على وظيفة الخلايا الغضروفية.
زراعة طبقة واحدة من الخلايا الغضروفية
يتميز النمط الظاهري المتمايز للخلايا الغضروفية في المقام الأول بتخليق الكولاجين من النوع الثاني والبروتيوغليكانات الخاصة بالأنسجة، بالإضافة إلى انخفاض مستوى النشاط الانقسامي. هناك دليل على أنه مع زراعة الخلايا لفترات طويلة في طبقة أحادية، وكذلك بعد عدة ممرات خلوية متكررة، تفقد الخلايا الغضروفية حدودها الكروية وتكتسب شكلًا ممدودًا يشبه الخلايا الليفية. مع هذا التحول التنسجي الليفي، يتم أيضًا تعديل الوظيفة التركيبية للخلايا، والتي تتميز بانخفاض تدريجي في تخليق الكولاجينات من النوع الثاني والتاسع والحادي عشر وزيادة في تخليق الكولاجينات من النوع الأول والثالث وY. يتم تخليق البروتيوغليكانات الصغيرة غير المتجمعة بسبب الأجريكان الوظيفي. يكون تخليق الكاثيبسين B وL منخفضًا للغاية في الخلايا المتمايزة، ولكنه يزداد في عملية فقدان التمايز. يتم التعبير عن الكولاجيناز-1 في الخلايا الغضروفية المتمايزة؛ مع إطالة فترة الزراعة، ينخفض التعبير عنه، في حين يزداد إنتاج مثبطات الأنسجة للميتالوبروتيناز (TIMPs).
تُعيد الخلايا الغضروفية المتمايزة التعبير عن الكولاجين من النمط الظاهري المتمايز عند نقلها من الطبقة الأحادية إلى المزرعة المُعلّقة. ويُرجّح أن عملية التمايز مرتبطة بشكل الخلية. وتُستخدم هذه الخاصية بانتظام من قِبل الباحثين الذين يدرسون الطعوم المعيبة ذات الخلايا الغضروفية الذاتية. ويمكن توسيع عدد قليل من الخلايا المأخوذة من مادة الخزعة في مزرعة أحادية الطبقة، ثم إعادة إدخالها في مصفوفة ثلاثية الأبعاد قبل الزرع. ويمكن تحفيز إعادة التعبير عن نمط ظاهري مُحدد بواسطة الخلايا الغضروفية غير المتمايزة المنقولة إلى مزرعة الأغاروز بواسطة TGF-β، ومركب أوسين-هيدروكسي أباتيت، وحمض الأسكوربيك.
استجابةً لعوامل النمو والسيتوكينات، تتحور الخلايا الغضروفية أثناء عملية التمايز. تختلف الاستجابة الخلوية للسيتوكينات وعوامل النمو بين الخلايا الغضروفية غير المتمايزة والمتمايزة. يُحفّز الإنترلوكين-1 تكاثر الخلايا الليفية، بينما يُثبّط نمو الخلايا الغضروفية غير المتمايزة بواسطة الإنترلوكين-1. يُحفّز عامل النمو الشبيه بالأنسولين (IGF-1) تخليق الحمض النووي (DNA) في الخلايا الغضروفية المستطيلة غير المسطحة. في الخلايا الغضروفية المتمايزة، تكون التأثيرات التحفيزية للإنترلوكين-1 بيتا وعامل نخر الورم ألفا (TNF-a) على إنتاج البروكولاجيناز أكثر وضوحًا منها في الخلايا الغضروفية غير المتمايزة.
زراعة الخلايا الغضروفية
تُثبّت زراعة الخلايا الغضروفية المُعلّقة في وسط سائل أو في مصفوفة ثلاثية الأبعاد طبيعية أو اصطناعية النمط الظاهري للخلايا الغضروفية. تحتفظ الخلايا بشكلها الكروي وتُصنّع بروتينات خاصة بالأنسجة. يُنصح عادةً بزراعة الخلايا الغضروفية المُعلّقة لدراسة تكوين مصفوفة جديدة حول الخلايا. تُستخدم مزارع الخلايا الغضروفية في بوليمرات ماصة اصطناعية أو طبيعية لزرع الخلايا في عيوب الغضروف لتحفيز تجديد أنسجة غضروف المفصل. يجب أن يستوفي الوسط الاصطناعي أو الطبيعي للخلايا المزروعة عددًا من المتطلبات:
- يجب أن تحتوي الغرسات على بنية مسامية لالتصاق الخلايا ونموها،
- لا ينبغي للبوليمر نفسه أو منتجات تحلله أن تسبب التهابًا أو تفاعلات سامة عند زراعته في الجسم الحي،
- يجب أن يكون حامل الطعم قادرًا على الارتباط بالغضروف المجاور أو العظم تحت الغضروفي،
- يجب أن تتمتع المصفوفة الطبيعية أو الاصطناعية بالقدرة على الامتصاص، ويجب موازنة تحللها عن طريق تجديد الأنسجة،
- لتسهيل إصلاح الغضروف، يجب أن يسهل التركيب الكيميائي وهندسة المسام في المصفوفة الحفاظ على النمط الظاهري الخلوي وتخليق البروتينات الخاصة بالأنسجة بواسطة الخلايا الغضروفية الموضوعة فيها،
- أثناء عملية الزرع داخل الجسم الحي، من الضروري دراسة الخصائص الميكانيكية للمصفوفة الاصطناعية أو الطبيعية.
 [ 12 ]، [ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]
[ 12 ]، [ 13 ]، [ 14 ]، [ 15 ]، [ 16 ]
تعليق الخلايا الغضروفية في الطور السائل
يمكن منع التصاق الخلايا بالأوعية البلاستيكية التي تُزرع فيها الخلايا الغضروفية عن طريق طلاء جدرانها بمحلول من ميثيل السليلوز، أو الأجاروز، أو هيدروجيل (بولي-2-هيدروكسي إيثيل ميثاكريلات)، أو خليط من الكولاجين والأجاروز. في هذه الظروف، تُشكل الخلايا الغضروفية مجموعات وتُركّب بشكل رئيسي الأغريكان والكولاجينات الخاصة بالأنسجة (الأنواع II، IX، XI). عادةً ما يوجد نوعان من الخلايا. تحتفظ الخلايا الموجودة في المركز بشكل كروي، وتحيط بها مصفوفة خارج الخلية (ECM) متطورة، وهو ما تؤكده الدراسات النسيجية والبنيوية الدقيقة. أما على المحيط، فتتميز الخلايا الغضروفية بخطوط قرصية، وتحيط بها مصفوفة خارج الخلية (ECM) قليلة؛ ولا يُعرف الكثير عن الخصائص الوظيفية لهذه الخلايا.
من الممكن زراعة الخلايا الغضروفية على ناقلات دقيقة محفوظة في محلول معلق؛ حيث تُستخدم حبيبات ديكستران (سايتودكس)، وحبيبات ديكستران مغلفة بالكولاجين (سايتودكس III)، وكرات مجهرية غير مسامية من الكولاجين من النوع الأول (سيلاجين) كناقلات دقيقة. في ظل ظروف الزراعة هذه، تلتصق الخلايا الغضروفية بسطح الناقل الدقيق، وتحافظ على شكلها الكروي، وتُنتج مادة تشبه المصفوفة. علاوة على ذلك، يُعزز استخدام السيلاجين تكاثر الخلايا الغضروفية وإعادة التعبير عن النمط الظاهري الطبيعي. لذلك، يمكن استخدام زراعة الخلايا الغضروفية على كريات سيلاجين الدقيقة لاستعادة النمط الظاهري للخلية قبل الزراعة.
هناك طريقة أخرى لزراعة معلقات الخلايا الغضروفية في وسط سائل، وهي زراعتها على شكل كرات كثيفة من الخلايا (0.5-1 × 10 ب )، والتي يتم الحصول عليها عن طريق الطرد المركزي. هذه الخلايا الغضروفية قادرة على إنتاج مصفوفة تحتوي على كمية كبيرة من البروتيوغليكان، الكولاجين من النوع الثاني، ولكن ليس الكولاجين من النوع الأول، وهو ما تؤكده الطرق النسيجية والمناعية الكيميائية والكمية.
تعليق الخلايا الغضروفية في المصفوفة خارج الخلوية الطبيعية
يمكن زراعة الخلايا الغضروفية في معلق في مصفوفة ثلاثية الأبعاد (أجار ناعم، أجاروز، جل أو إسفنجة الكولاجين، حمض الهيالورونيك، غراء الفيبرين، حبيبات الألجينات).
تحتفظ الخلايا الغضروفية المزروعة في الأغاروز بنمطها الظاهري الطبيعي وتُصنّع الكولاجين من النوع الثاني وتجمعات الأجريكان الخاصة بالأنسجة. عند زراعتها في الأغاروز، تُطلق البروتيوغليكانات التي تُصنّعها الخلية في الوسط لمدة 50 يومًا. للمقارنة، في زراعة أحادية الطبقة، يكون الطور الخلوي ممتلئًا بالجليكوزامينوغليكان بالفعل في الأيام 5-6 الأولى من الزراعة؛ عند زراعتها في الوسط، بعد زيادة تخليق وإطلاق الجليكوزامينوغليكان في الأيام 8-10 الأولى، يحدث انخفاض في تركيزها مع مرور الوقت. ومع ذلك، يختلف سلوك الخلايا الغضروفية المزروعة في الأغاروز عن سلوكها في الجسم الحي. في الأغاروز، يحتوي عدد كبير من تجمعات الأجريكان المُصنّعة على جزيئات أصغر وجزيئات أقل مما هو عليه في الجسم الحي. يُحفّز TGF-β تخليق البروتيوغليكان في العينة المزروعة، ولكنه يُقلّل من تخليق الأجريكان في الأغاروز.
الألجينات عبارة عن عديد سكاريد خطي يُستخرج من الأعشاب البحرية البنية. في وجود كاتيونات ثنائية التكافؤ، مثل أيونات الكالسيوم ، يتحول هذا البوليمر إلى هلام. تُحاط كل خلية غضروفية محصورة في الألجينات بمصفوفة من عديدات السكاريد سالبة الشحنة، ومسامها مماثلة لتلك الموجودة في الغضروف الزجاجي. تتكون المصفوفة التي تُشكلها الخلايا الغضروفية في حبيبات الألجينات من حجرتين: طبقة رقيقة من المصفوفة المرتبطة بالخلايا، تُمثل المصفوفة المحيطة بالخلية والإقليمية للغضروف المفصلي، ومصفوفة أبعد تُعادل المصفوفة بين الأقاليم في النسيج الطبيعي. في اليوم الثلاثين من الزراعة، يكون الحجم النسبي والمطلق للخلايا وكل حجرة من الحجرتين في حبيبة الألجينات متطابقين تقريبًا مع تلك الموجودة في الغضروف الطبيعي. لمدة 30 يومًا تقريبًا، تحتفظ الخلايا الغضروفية بشكلها الكروي وتُنتج الأغريكان، الذي تُشبه خصائصه الهيدروديناميكية خصائص جزيئات الأغريكان في مصفوفة الغضروف المفصلي، بالإضافة إلى جزيئات الكولاجين من الأنواع II وIX وXI. في الوقت نفسه، وكما هو الحال في مزارع التعليق الأخرى، توجد خلايا مسطحة على سطح حبيبات الألجينات، والتي تُنتج كمية صغيرة من جزيئات الكولاجين من النوع I، والتي تُطلق مباشرةً في الوسط ولا تُدمج في المصفوفة خارج الخلوية. يُلاحظ تكاثر متوسط للخلايا الغضروفية في حبيبات الألجينات. بعد 8 أشهر من الزراعة في هلام الألجينات، لا تفقد الخلايا الغضروفية الناضجة نشاطها الأيضي، وتواصل تخليق الكولاجين من النوع II والأغريكان الخاص بالأنسجة.
قام هـ. تاناكا وآخرون (1984) بدراسة خصائص انتشار جزيئات طبيعية مختلفة في الألجينات، ووجدوا أن الجزيئات التي يزيد وزنها عن 70 كيلو دالتون لا تنتشر عبرها. وبالتالي، تُعدّ زراعة الخلايا في الألجينات مناسبة لدراسة تنظيم تخليق المصفوفة وتنظيم المصفوفة خارج الخلوية. يتيح توافر الخلايا المزروعة في الألجينات دراسة تأثير عوامل تنظيم الببتيد والعوامل الدوائية على المستويات النسخية، وما بعد النسخية، والترجمة.
تُزرع الخلايا الغضروفية أيضًا في مصفوفة من ألياف الكولاجين من النوعين الأول والثاني. قارن س. نيرير وآخرون (1997) وظيفة الخلايا الغضروفية الكلبية في مصفوفات بوليمر الكولاجين-البروتيوغليكان المسامية التي تحتوي على كولاجينات من أنواع مختلفة. ووجدوا اختلافات مهمة في مورفولوجيا الوظيفة الحيوية للخلايا الغضروفية المزروعة في مصفوفات الكولاجين التي تحتوي على الكولاجين من النوعين الأول والثاني. احتفظت الخلايا في مصفوفة الكولاجين من النوع الثاني بشكلها الكروي، بينما كان لها في الكولاجين من النوع الأول مورفولوجيا تشبه الخلايا الليفية. علاوة على ذلك، في مصفوفة الكولاجين من النوع الثاني، أنتجت الخلايا الغضروفية كمية أكبر من الغليكوز أمينوغليكان. قارن ج. فان سوسانتي وآخرون (1995) خصائص الخلايا الغضروفية المزروعة في هلام الألجينات والكولاجين (النوع الأول). لاحظ الباحثون زيادة ملحوظة في عدد الخلايا في هلام الكولاجين، ولكن ابتداءً من اليوم السادس من الزراعة، فقدت الخلايا نمطها الظاهري المميز، وتحولت إلى خلايا شبيهة بالخلايا الليفية. في هلام الألجينات، لوحظ انخفاض في عدد الخلايا، بينما احتفظت الخلايا الغضروفية بنمطها الظاهري الطبيعي. في هلام الكولاجين، كان عدد البروتيوغليكان لكل خلية أعلى بكثير منه في الألجينات، ولكن في هلام الكولاجين، لوحظ انخفاض في تخليق عناصر المصفوفة، ابتداءً من اليوم السادس من الزراعة، بينما استمر التخليق في الألجينات في الازدياد.
مصفوفة الفيبرين الصلبة ثلاثية الأبعاد هي مادة طبيعية تدعم الخلايا الغضروفية المعلقة فيها بنمط ظاهري متمايز. ويمكن أيضًا استخدام مصفوفة الفيبرين ثلاثية الأبعاد كحامل في زراعة الخلايا الغضروفية. تتمثل مزايا الفيبرين في عدم سميته الخلوية، وقدرته على ملء الفراغ، وقدرته على الالتصاق. وقد أظهرت الدراسات النسيجية والكيميائية الحيوية، والتصوير الشعاعي، والمجهر الإلكتروني أن الخلايا الغضروفية في هلام الفيبرين تحتفظ بشكلها، وتتكاثر، وتُنتج مصفوفة حتى بعد أسبوعين من الزراعة. ومع ذلك، أفاد ج. هومينغا وآخرون (1993) أن تفكك الفيبرين يبدأ بعد 3 أيام من الزراعة، ويتطور عدم تمايز الخلايا الغضروفية.
تعليق الخلايا الغضروفية في المصفوفة خارج الخلوية الاصطناعية (الصناعية)
يمكن الحصول على غرسات الغضاريف للجراحة الترميمية أو العظام عن طريق زراعة الخلايا الغضروفية المعزولة في المختبر في مصفوفة متوافقة حيويا اصطناعيا.
تتكاثر الخلايا الغضروفية المزروعة في حمض البولي جليكوليك وتحافظ على شكلها ونمطها الظاهري الطبيعيين لمدة 8 أسابيع. يتكون مركب الخلايا الغضروفية وحمض البولي جليكوليك من خلايا، وغليكوز أمينوغليكان، وكولاجينات، وله كبسولة كولاجين خارجية. ومع ذلك، تحتوي هذه الغرسات على نوعين من جزيئات الكولاجين - الأول والثاني. تحتوي الغرسات من الخلايا الغضروفية غير المتمايزة بسلسلة من الممرات على كمية أكبر من الغليكوز أمينوغليكان والكولاجينات مقارنةً بالغرسات من الخلايا الغضروفية غير المتمايزة في المقام الأول.
قارن ل. فريد وآخرون (1993ب) سلوك مزارع الخلايا الغضروفية البشرية والبقرية في حمض البولي جليكوليك الليفي (FPGA) وحمض البولي لاكتيك المسامي (PPLA). بعد 6-8 أسابيع من زراعة الخلايا الغضروفية البقرية في FPGA أو PPLA، لاحظ الباحثون تكاثرًا خلويًا وتجديدًا لمصفوفة الغضروف. في FPGA، كانت الخلايا الغضروفية كروية الشكل وتقع في فجوات محاطة بمصفوفة غضروفية. بعد 8 أسابيع من الزراعة في المختبر، احتوت الأنسجة المتجددة على ما يصل إلى 50% من المادة الجافة (4% كتلة خلوية، 15% جليكوز أمينوغليكان، و31% كولاجين). في PPLA، كان للخلايا شكل مغزلي وكمية صغيرة من الجليكوز أمينوغليكان والكولاجين. في FPGA، كان نمو الخلايا أكثر كثافة بمرتين منه في PPLA. في الجسم الحي، أنتجت الخلايا الغضروفية المزروعة في VPGK وPPLC أنسجةً مشابهةً نسيجيًا للغضروف خلال شهر إلى ستة أشهر. احتوت الغرسات على غليكوز أمينوغليكان، وكولاجينات من النوع الأول والثاني.
زُرعت غضاريف جنينية بقرية في بولي إيثيلين مسامي عالي الكثافة، كاره ومحب للماء. بعد 7 أيام من الحضانة في كلا الركيزتين، احتفظت الخلايا بشكلها الكروي، واحتوت بشكل أساسي على الكولاجين من النوع الثاني. بعد 21 يومًا من الزراعة، وُجد أن المصفوفة المحبة للماء تحتوي على كولاجين من النوع الثاني أكثر من المصفوفة الكارهة للماء.
يمكن أيضًا الحصول على أنسجة الغضروف عن طريق زراعتها في طبقة أحادية على مرشحات Millicell-CM. يُعد الطلاء المسبق للمرشحات بالكولاجين ضروريًا لالتصاق الكوندرويتين. يُظهر الفحص النسيجي للزراعة تراكم الخلايا الغضروفية في المصفوفة خارج الخلوية التي تحتوي على بروتيوغليكان وكولاجين من النوع الثاني. لم يتم الكشف عن الكولاجين من النوع الأول في مثل هذه المزرعة. تكون الخلايا الغضروفية في نسيج الغضروف المُحصل عليه كروية الشكل، ولكنها مسطحة بعض الشيء على سطح النسيج. يزداد سمك النسيج المُشكل حديثًا بمرور الوقت ويعتمد على الكثافة الأولية للطبقة أحادية الخلية. في ظل ظروف الزراعة المثلى، وصل سمك نسيج الغضروف إلى 110 ميكرومتر، ويشبه تنظيم خلاياه والكولاجين في طبقات سطحية وعميقة تنظيم الغضروف المفصلي. تحتوي المصفوفة خارج الخلوية على ما يقرب من ثلاثة أضعاف الكولاجين والبروتيوغليكان. بعد أسبوعين من الزراعة، لوحظ تراكم المصفوفة، مما يسمح باستخراج النسيج من المرشح واستخدامه للزراعة.
درس سيمز وآخرون (1996) زراعة الخلايا الغضروفية في هلام أكسيد البولي إيثيلين، وهو مصفوفة بوليمرية مغلفة تسمح بنقل أعداد كبيرة من الخلايا عن طريق الحقن. بعد ستة أسابيع من الحقن في النسيج تحت الجلد لفئران لا زُرع فيها الغضروف، تكوّن غضروف جديد، اتسم شكليًا ببريق أبيض يشبه الغضروف الزجاجي. أشارت البيانات النسيجية والكيميائية الحيوية إلى وجود خلايا غضروفية نشطة التكاثر تُنتج المصفوفة خارج الخلوية.
الزرع
تُستخدم عملية زراعة أنسجة الغضروف لدراسة عمليات البناء والهدم فيها، والحفاظ على التوازن الداخلي، والامتصاص والإصلاح. تحافظ الخلايا الغضروفية في عينات الغضروف المزروعة على نمط ظاهري طبيعي وتركيب ECM مماثل لتلك الموجودة في الغضروف المفصلي في الجسم الحي. بعد 5 أيام من الزراعة في وجود المصل، يتم تحقيق مستوى ثابت من عمليات التخليق والتحلل الطبيعي. يمكن تسريع امتصاص الأنسجة في المزرعة الرئيسية وفي المزرعة بإضافة المصل باستخدام عدد من العوامل، مثل IL-IB وTNF-a وlipopolysaccharides البكتيرية ومشتقات حمض الريتينويك أو جذور الأكسجين النشطة. لدراسة إصلاح الغضروف، يتم إحداث تلفه بواسطة وسطاء التهابيين قابلين للذوبان (H 2 O 2 وIL-1 وTNF-a) أو تمزق مادي للمصفوفة.
طريقة الزراعة العضوية هي نموذج للدراسات المختبرية لتأثيرات العوامل الخارجية المعزولة على الخلايا الغضروفية والمصفوفة المحيطة بها. في الجسم الحي، تتواجد الخلايا الغضروفية بشكل متفرق في المصفوفة خارج الخلوية، ولا تلامس بعضها البعض. تحافظ زراعة عينة الغضروف المفصلي على هذا التنظيم الهيكلي، بالإضافة إلى التفاعلات المحددة بين الخلايا الغضروفية والبيئة المحيطة خارج الخلوية. يُستخدم هذا النموذج أيضًا لدراسة تأثيرات الإجهاد الميكانيكي، والعوامل الدوائية، وعوامل النمو، والسيتوكينات، والهرمونات على أيض الغضروف.
من مزايا زراعة أنسجة الغضاريف عدم تضرر الخلايا الغضروفية بفعل الإنزيمات المحللة للبروتين أو العوامل الميكانيكية، وهو أمرٌ لا مفر منه عند عزل الخلايا. تُحمى المستقبلات وبروتينات الغشاء الأخرى والجليكوبروتينات من العوامل الضارة.
 [ 17 ]، [ 18 ]، [ 19 ]، [ 20 ]، [ 21 ]
[ 17 ]، [ 18 ]، [ 19 ]، [ 20 ]، [ 21 ]
ثقافة الغضروف
الغضروف هو وحدة هيكلية ووظيفية واستقلابية في الغضروف المفصلي، تتكون من خلية غضروفية ومصفوفتها المحيطة ومحفظتها الخيطية المدمجة، وهي مسؤولة عن استتباب المصفوفة. تُستخرج الغضروفات ميكانيكيًا من الغضروف وتُجمع باستخدام عدة عمليات تجانس متتالية منخفضة السرعة. يمكن تقسيم الغضروفات المعزولة من مناطق ذات أعماق غضروفية مختلفة إلى أربع فئات: غضروف مفرد، غضروف مزدوج، غضروف متعدد (ثلاثة أو أكثر) مرتبة خطيًا (أعمدة غضروفية)، ومجموعات غضروفية.
عادةً ما توجد الغضاريف المفردة في الطبقات الوسطى من الغضروف السليم، بينما توجد الغضاريف المزدوجة على حدود الطبقتين الوسطى والعميقة، أما الغضاريف المتعددة المرتبة خطيًا فهي سمة مميزة للطبقات العميقة من الغضروف السليم. وأخيرًا، تتكون مجموعات الغضاريف من مجموعات منظمة عشوائيًا من الغضاريف المفردة والمزدوجة، والتي تحتفظ بحالة مجمعة بعد التجانس. مجموعات الغضاريف هي شظايا كبيرة من الغضروف، تحتوي عادةً على عدة غضاريف وألياف كولاجين مرتبة شعاعيًا، أي سمة تنظيمية نموذجية للطبقات العميقة من المصفوفة. تُثبّت الغضاريف في أغاروز شفاف، مما يسمح بدراسة بنيتها وتركيبها الجزيئي ونشاطها الأيضي. يُعتبر نظام الغضروف-أغاروز نموذجًا مصغرًا للغضروف، ويختلف عن نظام الغضروف-أغاروز التقليدي في الحفاظ على البيئة الدقيقة الطبيعية، وعدم الحاجة إلى تصنيعها وتجميعها. تعد زراعة الغضروف نموذجًا لدراسة تفاعلات الخلايا والمصفوفة في الغضروف المفصلي في ظل الظروف الطبيعية والمرضية.
 [ 22 ]، [ 23 ]، [ 24 ]، [ 25 ]، [ 26 ]، [ 27 ]
[ 22 ]، [ 23 ]، [ 24 ]، [ 25 ]، [ 26 ]، [ 27 ]
زراعة الخلايا الغضروفية الخالدة
تُستخدم الفيروسات التي تحتوي على الحمض النووي المُعاد التركيب أو الجينات السرطانية القادرة على جعل الخلية "خالدة" لإنشاء سلالات خلوية دائمة. تتمتع الخلايا الغضروفية الخالدة بالقدرة على التكاثر بلا حدود مع الحفاظ على نمط ظاهري مستقر. أظهر ف. مالين-جيرين وآخرون (1995) أن جين الأورام SV40T يُحفز تكاثر الخلايا الغضروفية لدى الفئران، والتي تستمر في التعبير بشكل ثابت عن أنواع الكولاجين الثاني والتاسع والحادي عشر، بالإضافة إلى بروتين الأجريكان المفصلي وبروتين الربط. ومع ذلك، تكتسب هذه السلالة الخلوية القدرة على تخليق الكولاجين من النوع الأول عند زراعتها في مزرعة أحادية الطبقة أو في هلام الأجاروز.
وصف دبليو. هورتون وآخرون (1988) سلالة من الخلايا الخالدة ذات مستوى منخفض من التعبير عن mRNA الكولاجيني من النوع الثاني. حُصل على هذه الخلايا بتحويلها باستخدام فيروس رجعي فأري يحتوي على جينات الأورام I-myc وy-ra. يُمثل هذا النوع من الخلايا نموذجًا فريدًا لدراسة تفاعلات المصفوفة المفصلية في غياب الكولاجين من النوع الثاني، بالإضافة إلى تنظيم تخليق الكولاجين من النوع الثاني.
تُعدّ زراعة الغضروفيات ذات الجينات الطافرة أو المحذوفة نموذجًا مناسبًا لدراسة وظيفتها الفسيولوجية. يُعدّ هذا النموذج مناسبًا بشكل خاص لدراسة دور جزيئات محددة في تنظيم مصفوفة الغضروف أو للتحقيق في آثار العوامل التنظيمية المختلفة على أيض الغضروف. تُصنّع الخلايا الغضروفية ذات الجين المحذوف للكولاجين من النوع التاسع لييفات كولاجينية أعرض من الطبيعي، مما يشير إلى أن الكولاجين من النوع التاسع يُنظّم قطر اللييفات. وكما ذُكر في الفصل الأول، اكتُشفت مؤخرًا طفرة في جين COLAI المُشفّر للكولاجين من النوع الثاني لدى عائلات مُصابة بهشاشة العظام الأولية المُعمّمة. لدراسة تأثير الكولاجين من النوع الثاني الطافر على المصفوفة المفصلية، قام ر. دارمرفارام وآخرون (1997) بنقل COL 2 AI المُعيب (المُصاب بحمض نووي غريب) (حيث استُبدل الأرجينين في الموضع 519 بالسيستين) إلى خلايا غضروفية جنينية بشرية في المختبر.
نظام الزراعة المشتركة. في المفصل، يتفاعل الغضروف مع أنواع أخرى من الخلايا الموجودة في الغشاء الزليلي، والسائل الزليلي، والأربطة، والعظم تحت الغضروفي. يمكن أن يتأثر أيض الخلايا الغضروفية بعوامل ذائبة مختلفة تُصنّعها الخلايا المذكورة. لذلك، في التهاب المفاصل، يُدمّر الغضروف المفصلي بواسطة الإنزيمات المحللة للبروتين والجذور الحرة التي تُنتجها الخلايا الزلالية. لذلك، طُوّرت نماذج لدراسة التفاعلات المعقدة بين الغضروف والأنسجة المحيطة به، والتي تُسمى الزراعة المشتركة.
قام س. لاكومب-جليز وآخرون (1995) بزراعة خلايا غضروفية وخلايا بانيات عظمية من الأرانب في نظام زراعة مشتركة (COSTAR)، حيث فُصلت الخلايا بغشاء دقيق المسام (0.4 ميكرومتر)، مما يسمح بالتبادل بين نوعي الخلايا دون أي تلامس مباشر. أظهرت هذه الدراسة قدرة الخلايا بانيات العظم على تحفيز نمو الخلايا الغضروفية عبر وسطاء قابلين للذوبان.
درس إيه إم مالفيت وزملاؤه (1994) العلاقة بين الخلايا الوحيدة في الدم المحيطي والخلايا الغضروفية. يُعد هذا النموذج مناسبًا لدراسة العمليات التي تتوسطها السيتوكينات في الاعتلالات المفصلية الالتهابية (التهاب المفاصل الروماتويدي، والتهاب الفقار اللاصق المصلي السلبي، وغيرها). فصل مؤلفو النموذج الخلايا بغشاء رابط للبروتين ذي مسام قطرها 0.4 ميكرومتر. أظهرت الدراسة أن الخلايا الوحيدة المحفزة بالليبوبولي سكاريد أنتجت IL-1 وTNF-a، مما يثبط تخليق الأجريكان بواسطة الخلايا الغضروفية ويساهم في تحلل تجمعات الأجريكان المُصنّعة مسبقًا.
ابتكر ك. تادا وآخرون (1994) نموذج زراعة مشتركة، حيث وُضعت خلايا بطانية في هلام كولاجين (النوع الأول) في حجرة داخلية منفصلة عن الحجرة الخارجية، ووُضعت فيها خلايا غضروفية بواسطة مرشح ذي مسام 0.4 ميكرومتر. في حالة عزل تام عن الحجرة الخارجية، شكلت خلايا بطانية بشرية أنابيب في هلام كولاجين بوجود عامل نمو البشرة (EGF) أو عامل نمو الخلايا المحولة (TGF-a). عند زراعة كلا النوعين من الخلايا في وقت واحد، تم تثبيط تكوين الأنابيب المعتمدة على عامل نمو الخلايا المحولة (TGF-a) بواسطة الخلايا البطانية. تم القضاء جزئيًا على تثبيط هذه العملية بواسطة الخلايا الغضروفية بواسطة الأجسام المضادة لعامل نمو الخلايا المحولة (TGF-beta). يمكن افتراض أن عامل نمو الخلايا المحولة (TGF-beta) الذي تنتجه الخلايا الغضروفية يثبط تكوين الأوعية الدموية في الغضروف نفسه.
قام إس. جروت وآخرون (1994) بزراعة خلايا غضروفية من مناطق تضخم وتكاثر عظم جنين فأر عمره 16 يومًا في آنٍ واحد باستخدام قطع من أنسجة المخ. بعد 4 أيام من الزراعة، لوحظ تحول الخلايا الغضروفية إلى خلايا بانيات العظم وبداية تكوين العظم. بعد 11 يومًا من الزراعة، استُبدل جزء من الغضروف بنسيج عظمي، وتكلس مصفوفة العظم جزئيًا. تؤثر بعض الببتيدات العصبية والنواقل العصبية التي ينتجها نسيج المخ على استقلاب الخلايا بانيات العظم أو تحتوي على مستقبلات لها. من بينها النورإبينفرين، والببتيد المعوي الوعائي، والببتيد المرتبط بجين الكالسيتونين، والمادة P، والسوماتوستاتين. يمكن لقطع من أنسجة المخ المزروعة مع الخلايا الغضروفية أن تنتج بعض العوامل المذكورة القادرة على تحفيز عملية تحول الخلايا الغضروفية إلى خلايا بانيات العظم.
 [ 28 ]، [ 29 ]، [ 30 ]، [ 31 ]، [ 32 ]، [ 33 ]
[ 28 ]، [ 29 ]، [ 30 ]، [ 31 ]، [ 32 ]، [ 33 ]
تأثير العوامل الخارجية على زراعة الخلايا الغضروفية
تأثير توتر الأكسجين على أيض الخلايا الغضروفية
في معظم الحالات، تتطور مزارع الخلايا الغضروفية في ظل ظروف توتر الأكسجين الجوي. ومع ذلك، فمن المعروف جيدًا أن الخلايا الغضروفية في الجسم الحي توجد في ظل ظروف نقص الأكسجين ويختلف توتر الأكسجين في ظل ظروف مرضية مختلفة. أثناء عملية النضج، تُلاحظ تغييرات كبيرة في إمداد الدم إلى المشاش. نظرًا لأن الأوعية الدموية تختلف في مناطق مختلفة من صفيحة النمو، فإن توتر الأكسجين فيها يختلف أيضًا. أظهر سي برايتون و آر هيبنستال (1971) أنه في الصفيحة الظنبوبية للأرانب، يكون توتر الأكسجين في المنطقة الضخامية أقل منه في الغضروف المحيط. أظهرت قياسات بعض المعلمات الأيضية أن الخلايا الغضروفية قادرة على الاستجابة بسرعة للتغيرات الموضعية في تركيز الأكسجين. أولاً وقبل كل شيء، عند انخفاض توتر الأكسجين، ينخفض استهلاكه بواسطة الخلايا الغضروفية. مع انخفاض توتر الأكسجين من 21 إلى 0.04٪، يزداد استخدام الجلوكوز، ويزداد نشاط إنزيمات التحلل السكري وتخليق حمض اللاكتيك. حتى عند انخفاض مستوى الأكسجين، تبقى الكمية المطلقة من ATP وADP وAMP ثابتة. تشير هذه البيانات إلى أن أيض الخلايا الغضروفية يهدف إلى الحفاظ على أقصى قدر من الطاقة. ومع ذلك، يتغير النشاط التركيبي، وبالتالي عمليات الإصلاح، في ظل ظروف نقص الأكسجين.
يؤثر ارتفاع مستوى الأكسجين أيضًا على أيض الخلايا الغضروفية، مما يُسبب انخفاضًا في تخليق البروتيوغليكان والحمض النووي (DNA)، وتدهورًا في مصفوفة الغضروف. وعادةً ما يصاحب هذه التأثيرات إنتاج جذور الأكسجين الحرة.
تأثير تركيز الأيونات والضغط الأسموزي للبيئة على وظيفة الخلايا الغضروفية
في الغضروف الطبيعي، يختلف تركيز الأيونات اختلافًا كبيرًا عن تركيزها في الأنسجة الأخرى: إذ يتراوح محتوى الصوديوم في الوسط خارج الخلوي بين 250 و350 ملي مول، وتركيزه الأسمولي بين 350 و450 موسمول. عند عزل الخلايا الغضروفية من المصفوفة خارج الخلوية وحضانتها في وسط قياسي (DMEM (وسط دولبيكو الأساسي الأدنى)، وتتراوح تركيزه الأسمولي بين 250 و280.7 موسمول)، تتغير البيئة المحيطة بالخلايا بشكل كبير. بالإضافة إلى ذلك، يكون تركيز الكالسيوم والبوتاسيوم في الوسط القياسي أقل بكثير منه في النسيج الطبيعي، ويكون تركيز الأنيونات أعلى بكثير.
تزيد إضافة السكروز إلى الوسط من تركيزه الاسموزي، وتُحدث زيادةً مؤقتةً داخل الخلايا في تركيز أيونات الهيدروجين (H +) وأنيونات الكالسيوم في السيتوزول. ويمكن أن تؤثر هذه التغيرات داخل الخلايا على عمليات تمايز الخلايا الغضروفية ونشاطها الأيضي. وقد وجد ج. أوربان وآخرون (1993) أن دمج 35-8 -كبريتات و3- H- برولين بواسطة الخلايا الغضروفية المعزولة التي حُضنت في DMEM القياسي لمدة 2-4 ساعات كان 10% فقط من مثيله في الأنسجة الطبيعية. وبلغت شدة التخليق ذروتها عند تركيز اسموزي للوسط خارج الخلية يتراوح بين 350 و400 موسمول، سواءً في الخلايا الغضروفية المعزولة حديثًا أو في عينات أنسجة الغضاريف. وعلاوةً على ذلك، زاد حجم الخلايا الغضروفية بنسبة 30-40% بعد وضع الخلايا المعزولة في DMEM القياسي ذي التركيز الاسموزي المحدد. ومع ذلك، عند زراعة الخلايا الغضروفية في ظل ظروف الضغط الأسمولي غير الفسيولوجية لمدة 12-16 ساعة، تتكيف الخلايا مع الظروف الجديدة، مما يقلل من شدة التخليق الحيوي بما يتناسب مع التحول في الضغط الأسمولي للبيئة خارج الخلية.
درس P. Borgetti وآخرون (1995) تأثير تركيز الوسط خارج الخلوي على نمو وشكل وتخليق الخلايا الغضروفية للخنازير. أظهر الباحثون سمات بيوكيميائية وشكلية مماثلة للخلايا الغضروفية المزروعة في بيئات ذات تركيز اسمولي 0.28 و0.38 موسمول. عند تركيز اسمولي وسط يبلغ 0.48 موسمول، لوحظ انخفاض في تكاثر الخلايا وتخليق البروتين خلال أول 4-6 ساعات من الزراعة، ولكن هذه المعلمات تعافت لاحقًا ووصلت في النهاية إلى قيم التحكم. عندما زرعت الخلايا الغضروفية في وسط ذي تركيز اسمولي 0.58 موسمول، فقدت الخلايا القدرة على الحفاظ على الكثافة الفسيولوجية لعمليات التكاثر، وبعد 6 أيام انخفض عدد الخلايا الغضروفية بشكل ملحوظ. عند تركيز اسمولي وسط يبلغ 0.58 موسمول، لوحظ تثبيط عميق لتخليق البروتين. بالإضافة إلى ذلك، عند زراعتها في أوساط ذات تركيز اسموزي يتراوح بين 0.28 و0.38 ميلي أسمول، تحتفظ الخلايا الغضروفية بنمطها الظاهري الفسيولوجي؛ أما عند ارتفاع التركيز الاسموزي (0.48-0.58 ميلي أسمول)، فتحدث تغيرات ملحوظة في مورفولوجيا الخلية، تتجلى في فقدان النمط الظاهري المميز، وتحول الخلايا الغضروفية إلى خلايا شبيهة بالخلايا الليفية، وفقدان قدرتها على تجميع بروتيوغليكان المصفوفة. تشير نتائج هذه الدراسة إلى قدرة الخلايا الغضروفية على الاستجابة لتقلبات محدودة في تركيز الاسموزي في البيئة خارج الخلوية.
يمكن أن تؤثر التغيرات في تركيز الأيونات الأخرى أيضًا على عمليات التخليق الحيوي في الخلايا الغضروفية. وبالتالي، تزداد درجة دمج 35 S (الكبريتات) بمقدار النصف مع زيادة تركيز أيونات البوتاسيوم من 5 ملي مول (التركيز في وسط DM EM القياسي) إلى 10 ملي مول (التركيز في ECM في الجسم الحي). عززت تركيزات الكالسيوم التي تقل عن 0.5 ملي مول إنتاج الكولاجين بواسطة الخلايا الغضروفية البقرية الناضجة، بينما تسبب تركيز 1-2 ملي مول (المقابل للتركيز في وسط DM EM القياسي) في انخفاض كبير في تخليق الكولاجين. لوحظت زيادة معتدلة في التخليق الحيوي عند مستويات الكالسيوم العالية (2-10 ملي مول). تشارك كاتيونات مختلفة في ارتباط الخلايا الغضروفية ببروتينات ECM. وبالتالي، توفر أيونات المغنيسيوم والمنغنيز ارتباطًا بالفيبرونيكتين والكولاجين من النوع الثاني، بينما لا تشارك أيونات الكالسيوم في ارتباط الخلايا الغضروفية بالبروتينات. وبالتالي، تشير نتائج الدراسات الموصوفة إلى تأثير التغيرات في الأيونات خارج الخلية من البوتاسيوم والصوديوم والكالسيوم والضغط الأسمولي للوسط على الوظيفة الحيوية للخلايا الغضروفية الحاضنة في الوسائط القياسية.
تأثير الإجهاد الميكانيكي على أيض الخلايا الغضروفية
يؤدي تثبيت المفصل إلى ضمور غضروفي قابل للعكس، مما يشير إلى الحاجة إلى محفزات ميكانيكية لعمليات التمثيل الغذائي الطبيعية في المصفوفة خارج الخلوية. في معظم الحالات، توجد نماذج زراعة الخلايا المستخدمة تحت ضغط جوي طبيعي. أظهر م. رايت وآخرون (1996) أن البيئة الميكانيكية تؤثر على أيض الخلايا الغضروفية، وأن استجابة الخلية تعتمد على شدة وتواتر التحميل الانضغاطي. أظهرت التجارب التي أجريت على عينات غضروف مفصلي سليم في المختبر انخفاضًا في تخليق البروتينات والبروتيوغليكان تحت تأثير التحميل الساكن، بينما يحفز التحميل الديناميكي هذه العمليات. الآليات الدقيقة لتأثير التحميل الميكانيكي على الغضروف معقدة، وربما ترتبط بتشوه الخلايا، والضغط الهيدروستاتيكي، والضغط الأسموزي، والجهد الكهربائي، ومستقبلات الخلايا السطحية لجزيئات المصفوفة. لدراسة تأثير كل من هذه المعلمات، من الضروري إنشاء نظام يمكن فيه تغيير معلمة واحدة بشكل مستقل. على سبيل المثال، لا تُعدّ زراعة الطعوم مناسبة لدراسة تشوه الخلايا، ولكن يُمكن استخدامها لدراسة التأثير العام للضغط على النشاط الأيضي للخلايا الغضروفية. يؤدي ضغط الغضروف إلى تشوه الخلايا، ويصاحبه أيضًا ظهور تدرج في الضغط الهيدروستاتيكي، وجهد كهربائي، وتدفق السوائل، وتغيرات في المعايير الفيزيائية والكيميائية مثل محتوى الماء في المصفوفة، وكثافة الشحنة الكهربائية، ومستوى الضغط الأسموزي. يُمكن دراسة تشوه الخلايا باستخدام خلايا غضروفية معزولة مغمورة في هلام الأجار أو الكولاجين.
طُوِّرت أنظمة عديدة لدراسة تأثير التحفيز الميكانيكي على مزرعة الخلايا الغضروفية. يستخدم بعض الباحثين أنظمة يُطبَّق فيها الضغط على مزرعة الخلايا من خلال الطور الغازي. وهكذا، لاحظ جي بي فيلدهوزن وآخرون (1979)، باستخدام ضغط 13 كيلو باسكال فوق الضغط الجوي بتردد منخفض (0.3 هرتز) لمدة 15 دقيقة، زيادة في تخليق cAMP والبروتيوغليكان وانخفاضًا في تخليق الحمض النووي. أظهر آر سميث وآخرون (1996) أن التعرض المتقطع لمزارع الخلايا الغضروفية البقرية الأولية للضغط الهيدروستاتيكي (10 ميجا باسكال) بتردد 1 هرتز لمدة 4 ساعات تسبب في زيادة تخليق الأجريكان والكولاجين من النوع الثاني، في حين أن الضغط الثابت لم يؤثر على هذه العمليات. وباستخدام نظام مماثل، أفاد رايت وآخرون (1996) أن الضغط الدوري على مزرعة الخلايا يرتبط بفرط استقطاب غشاء الخلية الغضروفية وتنشيط قنوات البوتاسيوم المعتمدة على Ca2 +. وبالتالي، تُؤثر قنوات الأيونات المُنشَّطة بالتمدد في غشاء الخلايا الغضروفية على تأثيرات الضغط الدوري. وتعتمد استجابة الخلايا الغضروفية للضغط الهيدروستاتيكي على ظروف زراعة الخلايا وتواتر الحمل المُطبَّق. وبالتالي، يُقلِّل الضغط الهيدروستاتيكي الدوري (5 ميجا باسكال) من اندماج الكبريتات في الطبقة الأحادية للخلايا الغضروفية بترددات 0.05 و0.25 و0.5 هرتز، بينما يزداد اندماج الكبريتات في غرسة الغضروف عند تردد أعلى من 0.5 هرتز.
أفاد م. بوشمان وآخرون (1992) أن الخلايا الغضروفية في هلاميات الأجار تُغيّر عملية التخليق الحيوي استجابةً للحمل الميكانيكي الثابت والديناميكي، بنفس طريقة العضو السليم المُستزرع. ووجد الباحثون أن الحمل الميكانيكي يُولّد مُحفّزًا فرط التناضح، يليه انخفاض في درجة الحموضة في الخلايا الغضروفية.
يمكن دراسة تأثير التمدد الميكانيكي على مزرعة خلايا مغمورة في هلام. يمكن إنشاء قوة التمدد باستخدام فراغ يتم التحكم فيه بواسطة الكمبيوتر. عندما يكون النظام تحت درجة معينة من الفراغ، يتم تمديد الجزء السفلي من طبق بتري مع مزرعة الخلايا بمقدار معروف، ويكون التشوه أعظميًا عند حواف الجزء السفلي من الطبق وأدنى في المنتصف. ينتقل التمدد أيضًا إلى الخلايا الغضروفية المزروعة في طبق بتري. باستخدام هذه الطريقة، أظهر K. Holm-vall et al. (1995) أنه في خلايا ساركوما الغضروف المزروعة في هلام الكولاجين (النوع الثاني)، يزداد التعبير عن mRNA لـ 2-integrin. يتمكن 2-βintegrinمن الارتباط بالكولاجين من النوع الثاني. يُعتبر مستقبلًا ميكانيكيًا، لأنه يتفاعل مع بروتينات ربط الأكتين، وبالتالي يربط ECM والهيكل الخلوي.
تأثير الرقم الهيدروجيني على أيض الخلايا الغضروفية
يكون الرقم الهيدروجيني للسائل الخلالي للمصفوفة خارج الخلوية لأنسجة الغضروف أكثر حمضية منه في الأنسجة الأخرى. حدد أ. ماروداس (1980) الرقم الهيدروجيني لمصفوفة الغضروف المفصلي عند 6.9. ووجد ب. ديامانت وآخرون (1966) الرقم الهيدروجيني 5.5 في ظل الظروف المرضية. من المعروف أن الخلايا الغضروفية تعيش عند مستوى منخفض من أكسجين الأكسجين (PO2)، مما يدل على الدور المهم لعملية تحلل الجلوكوز (95% من إجمالي عملية أيض الجلوكوز) في أيض هذه الخلايا؛ ويصاحب تحلل الجلوكوز إنتاج كمية كبيرة من حمض اللاكتيك.
بالإضافة إلى تحمض البيئة بواسطة منتجات تحلل الجلوكوز، فإن مكونات المصفوفة نفسها ذات أهمية كبيرة. تعدل الكمية الكبيرة من الشحنة السالبة الثابتة على البروتيوغليكان التركيب الأيوني خارج الخلية: لوحظ تركيز عالٍ من الكاتيونات الحرة (مثل H + و Na + و K + ) وتركيز منخفض من الأنيونات (مثل O2 و HCO3). بالإضافة إلى ذلك، تحت تأثير التحميل الميكانيكي، يتم طرد الماء من ECM، مما يؤدي إلى زيادة تركيز الشحنات السالبة الثابتة وجذب المزيد من الكاتيونات إلى المصفوفة. ويصاحب ذلك انخفاض في درجة الحموضة في البيئة خارج الخلية، مما يؤثر على درجة الحموضة داخل الخلايا، وبالتالي تعديل عملية التمثيل الغذائي للخلايا الغضروفية. درس R. Wilkin و A. Hall (1995) تأثير درجة الحموضة في البيئة خارج الخلية وداخلها على التخليق الحيوي للمصفوفة بواسطة الخلايا الغضروفية البقرية المعزولة. ولاحظوا تعديلًا مزدوجًا في تخليق المصفوفة مع انخفاض في درجة الحموضة. أدى الانخفاض الطفيف في الرقم الهيدروجيني (7.4
 [ 34 ]، [ 35 ]، [ 36 ]، [ 37 ]، [ 38 ]، [ 39 ]، [ 40 ]
[ 34 ]، [ 35 ]، [ 36 ]، [ 37 ]، [ 38 ]، [ 39 ]، [ 40 ]
تأثير تركيب وسط الثقافة على عملية التمثيل الغذائي للخلايا الغضروفية
يجب أن يتوافق وسط زراعة الخلايا الغضروفية مع الظروف التجريبية. في السنوات الأخيرة، استُخدم مصل العجل لتحسين ظروف الزراعة. مع ذلك، عند استخدام المصل، يجب مراعاة عدد من النقاط المهمة:
- النمو الخارجي للخلايا من محيط الأنسجة في مزارع الأعضاء،
- التباين في تركيب الأمصال من سلاسل مختلفة،
- وجود مكونات غير معروفة فيها،
- زيادة خطر التداخل والتشوهات عند دراسة تأثير العوامل البيولوجية المختلفة على النشاط الأيضي للخلايا.
من الأمثلة على ذلك دراسةٌ لتأثير عامل نمو البشرة (EGF) على الخلايا الغضروفية الغضروفية لدى الفئران. حفّز عامل نمو البشرة (EGF) دمجَ 3H -thymidine وزيادةَ محتوى الحمض النووي (DNA) في المزرعة. كان هذا التأثير أكثر وضوحًا عند تركيزات مصل منخفضة (<1%)، ولكن عند تركيزات عالية (>7.5%)، اختفى التأثير.
من المعروف أن مستويات التخليق والتحلل في DMEM المضاف إليه مصل العجل تزداد بشكل كبير مقارنة بالظروف الحية. قد تكون الاختلافات بين الأيض في الجسم الحي وفي المختبر ناتجة عن الاختلافات بين السائل الزليلي والوسط الذي تُزرع فيه الخلايا. قام لي وآخرون (1997) بزراعة غضاريف الأبقار الصغيرة في الأجار باستخدام وسط غذائي يحتوي على DMEM مضاف إليه 20٪ من مصل العجل وكمية كبيرة من السائل الزليلي الخيفي الطبيعي. أدى وجود السائل الزليلي في الوسط إلى زيادة في كمية البروتيوغليكان، تصل إلى 80٪ من إجمالي كمية السائل الزليلي. تشير هذه النتائج إلى أن السائل الزليلي في المزرعة يحفز مستوى من الأيض مماثلًا للمستوى في الجسم الحي، مع مستوى عالٍ من تخليق الغليكوز أمينوغليكان ومستوى منخفض من انقسام الخلايا.
أظهر G. Verbruggen وآخرون (1995) أن تخليق 35 S-arrpeKaHa بواسطة الخلايا الغضروفية البشرية المزروعة في الأجاروز في DMEM الخالي من المصل كان 20-30٪ من مستوى التخليق الملحوظ في DMEM المضاف إليه 10٪ من مصل العجل. حدد المؤلفون مدى استعادة IGF-1 أو IGF-2 أو TGF-R أو الأنسولين لإنتاج الأجريكان في وسط خالٍ من المصل. وخلص المؤلفون إلى أن 100 نانوغرام/مل من الأنسولين أو IGF-1 أو IGF-2 أعادت جزئيًا تخليق الأجريكان إلى 39-53٪ من مستوى التحكم. لم يُلاحظ أي تآزر أو تراكم مع مجموعة من العوامل المذكورة. في الوقت نفسه، حفز 10 نانوغرام/مل من TGF-R في وجود 100 نانوغرام/مل من الأنسولين تخليق الأجريكان إلى 90٪ أو أكثر من المستوى المرجعي. أخيرًا، لم يؤثر ترانسفيرين مصل الإنسان، بمفرده أو بالاشتراك مع الأنسولين، على تخليق الأجريكان. عند استبدال مصل العجل بألبومين مصل البقر، انخفض محتوى تجمعات الأجريكان بشكل ملحوظ. أدى إثراء وسط الزرع بالأنسولين أو IGF أو TGF-R إلى استعادة قدرة الخلايا جزئيًا على إنتاج تجمعات الأجريكان. علاوة على ذلك، فإن IGF-1 والأنسولين قادران على الحفاظ على التوازن الداخلي في مزارع الخلايا. بعد 40 يومًا من الزراعة في وسط غني بـ 10-20 نانوغرام/مل من IGF-1، تم الحفاظ على تخليق البروتيوغليكان عند نفس المستوى أو حتى أعلى مقارنة بالوسط الذي يحتوي على 20٪ من مصل العجل. استمرت العمليات الهدمية بشكل أبطأ في الوسط المخصب بـ IGF-1 مقارنة بالوسط المخصب بمحلول ألبومين 0.1٪، ولكنها أسرع إلى حد ما في الوسط المخصب بمصل 20٪. في المزارع طويلة العمر، يحافظ 20 نانوغرام/مل من IGF-1 على حالة مستقرة للخلايا.
قارن د. لي وآخرون (1993) تأثير تركيبة وسط الثقافة (DMEM، DMEM + 20٪ مصل العجل، DMEM + 20 نانوغرام / مل IGF-1) على تخليق الحمض النووي في ثقافة أنسجة الغضروف المزروعة، وثقافة أحادية الطبقة، وفي معلق أجار. عند الزراعة في أجار مع وجود المصل، لاحظ المؤلفون ميل الخلايا الغضروفية إلى التجمع في مجموعات كبيرة. احتفظت الخلايا المزروعة بدون مصل أو مع IGF-1 بشكل دائري في أجار، مجمعة في مجموعات صغيرة، لكنها لم تشكل تجمعات كبيرة. في أحادي الطبقة، كان تخليق الحمض النووي أعلى بكثير في الوسط المحتوي على المصل منه في الوسط المخصب بـ IGF-1؛ كان تخليق الحمض النووي في الأخير أعلى بكثير منه في الوسط غير المخصب. لم يتم العثور على أي اختلافات في تخليق الحمض النووي عندما تم زراعة الخلايا الغضروفية في معلق أجار في وسط غير مخصب وفي وسط مع IGF-1. وفي الوقت نفسه، كان زراعة معلقات الخلايا الغضروفية في الأجار في وسط مدعم بالمصل مصحوبًا بزيادة في تضمين النوكليوتيد المشع 3H -thymidine مقارنة بالوسائط الأخرى.
فيتامين ج ضروري لتنشيط الإنزيمات المشاركة في تكوين بنية حلزونية مستقرة لألياف الكولاجين. تُنتج الخلايا الغضروفية التي تعاني من نقص حمض الأسكوربيك أسلاف الكولاجين غير الحلزونية قليلة الهيدروكسيل، والتي تُفرز ببطء. يُؤدي تناول حمض الأسكوربيك (50 ميكروغرام/مل) إلى هيدروكسيل الكولاجين من النوعين الثاني والتاسع، وإفرازهما بكميات طبيعية. لم تؤثر إضافة فيتامين ج على مستوى تخليق البروتيوغليكان. لذلك، يُنظّم إفراز الكولاجين بشكل مستقل عن إفراز البروتيوغليكان.

