خبير طبي في المقال
منشورات جديدة
فيروس نقص المناعة البشري (HIV)
آخر مراجعة: 04.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
تم تحديد متلازمة نقص المناعة المكتسب كمرض محدد عام ١٩٨١ في الولايات المتحدة، عندما أصيب عدد من الشباب بأمراض خطيرة ناجمة عن كائنات دقيقة غير ممرضة أو ضعيفة الإمراض بالنسبة للأشخاص الأصحاء. كشفت دراسة للحالة المناعية للمرضى عن انخفاض حاد في عدد الخلايا الليمفاوية بشكل عام، والخلايا التائية المساعدة بشكل خاص. سُميت هذه الحالة بمتلازمة نقص المناعة المكتسب (الإيدز). أشارت طريقة العدوى (الاتصال الجنسي، عن طريق الدم ومكوناته) إلى الطبيعة المعدية للمرض.
تم اكتشاف العامل المسبب للإيدز في عام 1983 بشكل مستقل من قبل الفرنسي ل. مونتانييه، الذي أطلق عليه اسم فيروس اعتلال العقد اللمفاوية المرتبط بـ LAV، لأنه وجده في مريض مصاب باعتلال العقد اللمفاوية؛ والأمريكي ر. جالو، الذي أطلق على الفيروس اسم HTLV-III (فيروس الغدد اللمفاوية البشرية الثالث): كان قد اكتشف في السابق فيروسات الغدد اللمفاوية الأولى والثانية.
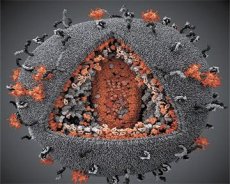
أظهرت مقارنة خصائص فيروسي LAV وHTLV-III هويتهما، لذا لتجنب الالتباس، سُمي الفيروس HIV (فيروس نقص المناعة البشرية، أو HIV) في عام 1986. يتميز فيروس نقص المناعة البشرية بشكله الكروي، وقطره 110 نانومتر. غلاف الفيروس على شكل متعدد السطوح، يتكون من 12 خماسيًا و20 سداسيًا. يوجد في مركز وزوايا كل سداسيّ جزيء من بروتين gpl20 المُغلَق (يشير الرقم 120 إلى الوزن الجزيئي للبروتين بالكيلو دالتون). يوجد ما مجموعه 72 جزيئًا من gpl20 على سطح الفيريون على شكل شوكات غريبة، يرتبط كل منها ببروتين الغشاء الداخلي gp41. تُشكل هذه البروتينات، مع الطبقة الدهنية المزدوجة، الغلاف الفائق (الغشاء) للفيريون.
يتشكل بروتينا gpl20 وgp41 عن طريق قطع بروتين Env السابق بواسطة بروتياز خلوي. يشكل بروتين gp41 "الجذع" الشوكي عن طريق الارتباط بمجاله السيتوبلازمي ببروتين المصفوفة p17MA الواقع مباشرة تحت الغلاف. تتفاعل جزيئات p17 أثناء نضج الفيريون لتكوين عشريني الوجوه أسفل الغلاف.
في الجزء المركزي من الفيريون، يُشكل بروتين p24 غلافًا مخروطيًا. يتصل الجزء الضيق من الغلاف بغشاء الفيريون بمشاركة بروتين rb. يوجد داخل الغلاف جزيئان متطابقان من الحمض النووي الريبوزي الجينومي الفيروسي. يتصلان من خلال طرفيهما 5' ببروتين الغلاف النووي p7NC. يتميز هذا البروتين باحتوائه على بقايا حمضين أمينيين (عناصر) غنيين بالسيستين والهيستيدين، ويحتويان على ذرة زنك - تُسمى هذه البقايا "أصابع الزنك" لأنها تلتقط جزيئات الحمض النووي الريبوزي الجينومي لإدراجها في الفيريونات المُشكّلة. يحتوي الغلاف أيضًا على ثلاثة إنزيمات. يشمل إنزيم الريفيرتاز (RT)، أو مُركب بول، إنزيم النسخ العكسي، وإنزيم RNase H، وبوليميراز الحمض النووي المعتمد على الحمض النووي. يوجد الريفيرتاز كمُثنوي متغاير p66/p51. يبدأ إنزيم البروتياز (PR) - p10 - عملية نضج الفيريون ويُنفذها. يضمن إنتيجراز (IN) - p31، أو نوكلياز داخلي، إدراج الحمض النووي الفيروسي في جينوم الخلية المضيفة. يحتوي الغلاف أيضًا على جزيء من الحمض النووي الريبوزي التمهيدي (tRNAl"3).
يُحوَّل جينوم الحمض النووي الريبوزي (RNA) في الخلية إلى جينوم الحمض النووي الريبوزي (DNA provirus) بمساعدة إنزيم النسخ العكسي، الذي يتكون من 9283 زوجًا من النيوكليوتيدات. يحده من اليسار واليمين ما يُسمى بالتكرارات الطرفية الطويلة (LTRs): S'-LTR على اليسار و3'-LTR على اليمين. يحتوي كلٌّ من التكرارات الطرفية الطويلة على 638 زوجًا من النيوكليوتيدات.
يتكون جينوم فيروس نقص المناعة البشرية من تسعة جينات، بعضها متداخل في نهاياته (لها عدة أطر قراءة)، ولها بنية إكسونينترونية. تتحكم هذه الجينات في تخليق تسعة بروتينات هيكلية وستة بروتينات تنظيمية.
تكمن أهمية LTRs بالنسبة للجينوم الفيروسي في أنها تحتوي على العناصر التنظيمية التالية التي تتحكم في عمله:
- إشارة النسخ (منطقة المحفز)؛
- إشارة إضافة بولي-أ؛
- إشارة التغطية؛
- إشارة التكامل؛
- إشارة تنظيمية إيجابية (TAR لبروتين TAT)؛
- العنصر التنظيمي السلبي (NRE لبروتين NEF)؛
- موقع لربط الحمض النووي الريبوزي التمهيدي (tRNA™3) لتخليق الحمض النووي الريبوزي منقوص الأكسجين في الطرف 3'؛ وإشارة في الطرف 5' من LTR تعمل كتمهيد لتخليق الحمض النووي الريبوزي منقوص الأكسجين.
بالإضافة إلى ذلك، يحتوي LTR على عناصر تُشارك في تنظيم ربط mRNA، أي تغليف جزيئات vRNA في الغلاف (عنصر Psi). وأخيرًا، أثناء نسخ الجينوم، تتشكل إشارتان في mRNAs الطويلة لبروتين REV، اللذان يُبدّلان عملية تخليق البروتين: CAR - للبروتينات التنظيمية، وCRS - للبروتينات الهيكلية. إذا ارتبط بروتين REV بـ CAR، يتم تخليق البروتينات الهيكلية؛ وإذا غاب، يتم تخليق البروتينات التنظيمية فقط.
تلعب الجينات التنظيمية التالية وبروتيناتها دورًا مهمًا بشكل خاص في تنظيم عمل جينوم الفيروس:
- بروتين TAT، الذي يقوم بالتحكم الإيجابي في تكاثر الفيروس ويعمل من خلال منطقة تنظيم TAR؛
- بروتينات NEV وVPU، التي تمارس سيطرة سلبية على التضاعف من خلال منطقة NRE؛
- بروتين REV، الذي يُجري التحكم الإيجابي والسلبي. يتحكم بروتين REV في عمل جينات gag وpol وenv، ويُجري التنظيم السلبي لعملية الوصل.
وهكذا، فإن تكاثر فيروس نقص المناعة البشرية يقع تحت سيطرة ثلاثية - إيجابية، سلبية، وإيجابية-سلبية.
يحدد بروتين VIF قدرة الفيروس المُصنّع حديثًا على العدوى. وهو مرتبط ببروتين الغلاف p24، ويوجد في الفيريون بكمية 60 جزيئًا. يُمثَّل بروتين NEF في الفيريون بعدد قليل من الجزيئات (5-10)، والتي قد تكون مرتبطة بالغلاف.
يثبط بروتين VPR دورة الخلية في الطور G2، ويشارك في نقل مُركّبات التكامل المسبق إلى نواة الخلية، ويُنشّط بعض الجينات الفيروسية والخلوية، ويزيد من كفاءة تكاثر الفيروس في الخلايا الوحيدة والبلعمية. لم يُحدَّد موقع بروتينات VPR وTAT وREV وVPU في الفيريون.
بالإضافة إلى بروتيناته الخاصة، قد يحتوي غشاء الفيريون على بعض بروتينات الخلية المضيفة. تشارك بروتينات VPU وVPR في تنظيم تكاثر الفيروس.
المتغيرات المستضدية لفيروس نقص المناعة البشرية (HIV)
فيروس نقص المناعة البشرية (HIV) متغير للغاية. حتى من جسم مريض واحد، يمكن عزل سلالات فيروسية تختلف اختلافًا كبيرًا في الخصائص المستضدية. يتم تسهيل هذا التنوع من خلال التدمير المكثف لخلايا CD4 + واستجابة الأجسام المضادة القوية لعدوى فيروس نقص المناعة البشرية. تم عزل شكل جديد من فيروس نقص المناعة البشرية، HIV-2، وهو قريب بيولوجيًا من HIV-1 ولكنه مختلف مناعيًا عنه، من مرضى من غرب إفريقيا. تبلغ نسبة التماثل في البنية الأساسية لجينومات هذه الفيروسات 42٪. يحتوي الحمض النووي للفيروس HIV-2 على 9671 زوجًا قاعديًا، ويبلغ طوله LTR 854 زوجًا قاعديًا. تم عزل HIV-2 لاحقًا في مناطق أخرى من العالم. لا توجد مناعة متبادلة بين HIV-1 و HIV-2. هناك شكلان كبيران معروفان من HIV-1: O (القيمة الشاذة) و M (الرئيسية)، وينقسم الأخير إلى 10 أنواع فرعية (AJ). تنتشر ثمانية أنواع فرعية (AH) في روسيا.
 [ 1 ]، [ 2 ]، [ 3 ]، [ 4 ]، [ 5 ]، [ 6 ]، [ 7 ]، [ 8 ]، [ 9 ]، [ 10 ]
[ 1 ]، [ 2 ]، [ 3 ]، [ 4 ]، [ 5 ]، [ 6 ]، [ 7 ]، [ 8 ]، [ 9 ]، [ 10 ]
آلية تفاعل فيروس نقص المناعة البشرية مع الخلية
بعد اختراقه الجسم، يهاجم الفيروس أولاً الخلايا التي تحتوي على مستقبل CD4 الخاص به. يوجد هذا المستقبل بكميات كبيرة في الخلايا التائية المساعدة، وبكميات أقل في الخلايا البلعمية والوحيدات، وهذه الخلايا حساسة بشكل خاص للفيروس.
يتعرف فيروس نقص المناعة البشرية (HIV) على مستقبلات CD4 باستخدام بروتين gpl20 الخاص به. تتم عملية تفاعل فيروس نقص المناعة البشرية مع الخلية وفقًا للمخطط التالي: الامتزاز بوساطة المستقبلات ← الحفرة المغلفة ← الحويصلة المغلفة ← الليزوزوم. في هذه العملية، يندمج غشاء الفيريون مع غشاء الليزوزوم، ويدخل الغلاف النووي، المتحرر من الغلاف الفائق، إلى السيتوبلازم؛ وفي طريقه إلى النواة، يُدمر، ويُطلق الحمض النووي الريبي الجينومي والمكونات الأساسية المرتبطة به. بعد ذلك، يُصنّع إنزيم النسخ العكسي الشريط السالب من الحمض النووي الريبي للفيريون، ثم يُدمّر إنزيم RNase H الحمض النووي الريبي للفيريون، ويُصنّع بوليميراز الحمض النووي الفيروسي الشريط الموجب من الحمض النووي الريبي. يتكون 5'-LTR و3'-LTR في نهايات طليعة الفيروس DNA. يمكن أن يبقى طليعة الفيروس في النواة لفترة من الوقت بشكل غير نشط، ولكن عاجلاً أم آجلاً، يتم دمجها في كروموسوم الخلية المستهدفة بمساعدة إنزيم الإنتيغريز الخاص بها. وفيها، تبقى طليعة الفيروس غير نشطة حتى يتم تنشيط الخلية اللمفاوية التائية المحددة بواسطة مستضدات ميكروبية أو خلايا أخرى كفؤة مناعية. يُنظم تنشيط نسخ الحمض النووي الخلوي عامل نووي خاص (NF-kB). وهو بروتين مرتبط بالحمض النووي، ويُنتج بكميات كبيرة أثناء تنشيط وتكاثر الخلايا اللمفاوية التائية والوحيدات. يرتبط هذا البروتين بتسلسلات معينة من الحمض النووي الخلوي وتسلسلات LTR مماثلة من طليعة الفيروس، ويحفز نسخ كل من الحمض النووي الخلوي وطليعة الفيروس. من خلال تحريض نسخ طليعة الفيروس، فإنه يُحوّل الفيروس من حالة غير نشطة إلى حالة نشطة، وبالتالي من عدوى مستمرة إلى عدوى منتجة. يمكن أن تبقى طليعة الفيروس غير نشطة لفترة طويلة جدًا. يعد تنشيط الفيروس لحظة حاسمة في تفاعله مع الخلية.
منذ لحظة دخول الفيروس إلى الخلية، تبدأ فترة الإصابة بفيروس نقص المناعة البشرية - وهي حالة حاملة للفيروس، والتي قد تستمر لعشر سنوات أو أكثر؛ ومنذ لحظة تنشيط الفيروس، يبدأ المرض - الإيدز. بمساعدة جيناته التنظيمية ومنتجاتها، يبدأ الفيروس بالتكاثر بنشاط. يمكن لبروتين TAT زيادة معدل تكاثر الفيروس بمقدار 1000 مرة. عملية النسخ الفيروسي معقدة، وتشمل تكوين كل من الحمض النووي الريبوزي المرسال (mRNA) كامل الطول والجزئي، وربط الحمض النووي الريبوزي المرسال (mRNA)، ثم تركيب البروتينات الهيكلية والتنظيمية.
يتم تخليق البروتينات الهيكلية على النحو التالي. أولاً، يتم تخليق البروتين السليف Pr55Gag (بروتين بوزن جزيئي 55 كيلو دالتون). يحتوي هذا البروتين على أربعة نطاقات رئيسية: المصفوفة (MA)، والقفيصة (CA)، والقفيصة النووية (NC)، ونطاق rb، والذي منه، نتيجة لقطع Pr55Gag بواسطة البروتياز الفيروسي (وهو قطع ذاتي من بروتين سليف آخر، Gag-Pol)، تتكون البروتينات الهيكلية p17 وp24 وp7 وrb على التوالي. يُعد تكوين البروتين السليف Pr55Gag الشرط الرئيسي لتكوين الجسيمات الفيروسية. وهو البروتين الذي يحدد برنامج تكوين الفيريون. ويشمل ذلك، بالتتابع، مراحل نقل البروتين السليف Gag إلى الغشاء البلازمي، والتفاعل معه، وتفاعلات البروتينات أثناء تكوين الجسيم الفيروسي وتبرعمه. يُصنع بروتين Pr55Gag على بولي ريبوسومات حرة؛ وتُنقل جزيئات البروتين إلى الغشاء، حيث تُثبّت بواسطة مناطقها الكارهة للماء. يلعب نطاق CA الدور الرئيسي في تكوين التركيب الطبيعي لبروتين Gag. يضمن نطاق NC تضمين جزيئين من الحمض النووي الريبوزي الجينومي (RNA) في تركيب الجسيم الفيروسي المُكوّن (بمساعدة "أصابع الزنك" الخاصة به). يتثنى جزيء البولي بروتين في البداية نتيجة تفاعل نطاقات المصفوفة. ثم تتحد المثنويات لتكوين معقدات سداسية (من 6 وحدات) نتيجة تفاعل نطاقي CA وNC. وأخيرًا، تتحد السداسيات عند أسطحها الجانبية لتشكل فيريونات كروية غير ناضجة، تحتوي داخلها على الحمض النووي الريبوزي الفيروسي الجينومي، الذي يلتقطه نطاق NC.
يُصنّع بروتين سلائف آخر، وهو Prl60Gag-Pol (وزنه الجزيئي 160 كيلو دالتون)، نتيجة انزياح إطاري في الريبوسوم أثناء ترجمة الطرف 3' لجين gag في المنطقة الواقعة مباشرةً قبل المنطقة المُشفّرة لبروتين rb. يحتوي هذا البروتين المتعدد Gag-Pol على تسلسل بروتين Gag غير مكتمل (1-423 حمضًا أمينيًا) وتسلسلات Pol التي تتضمن مجالات PR وRT وIN. تُصنّع جزيئات البروتين المتعدد Gag-Pol أيضًا على ريبوسومات متعددة حرة، وتُنقل إلى الغشاء البلازمي. يحتوي البروتين المتعدد Prl60Gagpol على جميع مواقع التفاعل بين الجزيئات ومواقع الارتباط بالغشاء المتأصلة في البروتين المتعدد Gag. لذلك، تندمج جزيئات عديد البروتين Gag-Pol مع الغشاء، وتُدمج مع جزيئات Gag في الفيريونات المُكوّنة، مما يؤدي إلى ظهور إنزيم بروتياز نشط وبدء عملية نضج الفيريون. يكون إنزيم بروتياز فيروس نقص المناعة البشرية-1 نشطًا للغاية فقط على شكل ثنائي الترابط، لذلك، يتطلب استئصاله الذاتي من Prl60Gag-Pol تكوين ثنائي الترابط لهذه الجزيئات. يتكون نضج الفيريون من قيام البروتياز النشط المُطلق بقطع prl60Gag-Pol وGag55 في المواقع التي يتعرف عليها؛ وتتشكل البروتينات p17 وp24 وp7 وp6 وrevertase وintegrase، ويحدث ارتباطها بالبنية الفيروسية.
يُصنع بروتين Env على الريبوسومات المرتبطة بأغشية الشبكة الإندوبلازمية، ثم يُغلَك، ويُقَطَّع بواسطة بروتياز خلوي إلى gp120 وgp41، ثم يُنقل إلى سطح الخلية. في هذه الحالة، يخترق gp41 الغشاء ويرتبط بمجالات مصفوفة جزيء بروتين Gag المرتبطة بالسطح الداخلي للغشاء. يُحفَظ هذا الارتباط في الفيريون الناضج.
وهكذا، يتكون تجميع الجسيمات الفيروسية من تجمع البروتينات السلفية وجزيئات الحمض النووي الريبوزي المرتبطة بها على الغشاء البلازمي للخلية المضيفة، وتكوين فيريونات غير ناضجة وإطلاقها بالتبرعم من سطح الخلية. أثناء التبرعم، يحيط الفيريون نفسه بغشاء خلوي تُدمج فيه جزيئات gp41 وgp120. أثناء التبرعم، أو ربما بعد إطلاق الفيريونات، يحدث نضجها، والذي يتم بمساعدة بروتياز فيروسي، ويتكون من تقطيع البروتينات السلفية Pr55Gag وPrl60Gag-Pol بالتحلل البروتيني إلى بروتينات الفيروس الناضج وارتباطها بمركبات هيكلية معينة. يلعب البروتين السليف متعدد البروتينات Pr55Gag الدور الرئيسي في عمليات التخلق الفيروسي، حيث ينظم ويجمع الفيريون غير الناضج؛ وتكتمل عملية نضجه بواسطة بروتياز فيروسي محدد.
أسباب نقص المناعة
أحد الأسباب الرئيسية لنقص المناعة في عدوى فيروس نقص المناعة البشرية هو الموت الجماعي للخلايا التائية المساعدة. يحدث ذلك نتيجةً للأحداث التالية. أولاً، تموت الخلايا التائية المساعدة المصابة بالفيروس نتيجةً للاستماتة. يُعتقد أن تكاثر الفيروس والاستماتة وانخفاض عدد الخلايا التائية المساعدة مترابطة لدى مرضى الإيدز. ثانياً، تتعرف الخلايا التائية القاتلة على الخلايا التائية المصابة بالفيروس أو التي تحمل جزيئات gpl20 الممتصة، وتدمرها، بالإضافة إلى الخلايا التائية المساعدة المصابة بالفيروس وغير المصابة بالفيروس، والتي تُشكل بلاستيدات خلوية (syncytium) تتكون من عشرات الخلايا (يموت بعضها نتيجةً لتكاثر الفيروسات فيها). نتيجةً لتدمير عدد كبير من الخلايا التائية المساعدة، ينخفض تعبير مستقبلات الغشاء في الخلايا اللمفاوية البائية للإنترلوكين-2، ويتعطل تخليق مختلف الإنترلوكينات (عوامل نمو وتمايز الخلايا اللمفاوية البائية - IL-4، IL-5، IL-6، إلخ)، مما يؤدي إلى خلل في وظيفة جهاز الخلايا التائية القاتلة. كما يُثبط نشاط جهازي المتمم والبلعم. لا تموت البلاعم والوحيدات المصابة بالفيروس لفترة طويلة، لكنها لا تستطيع التخلص منه. وأخيرًا، نظرًا للتشابه البنيوي والمستضدي لـ gpl20 مع مستقبلات بعض الخلايا الظهارية في الجسم (بما في ذلك مستقبلات الأرومة الغاذية التي تتوسط انتقال فيروس نقص المناعة البشرية عن طريق الزرع)، يتم تخليق أجسام مضادة للمستقبلات ذات طيف واسع من التأثير. تستطيع هذه الأجسام المضادة حجب مستقبلات خلوية مختلفة، وتُعقّد مسار المرض باضطرابات المناعة الذاتية. نتيجة الإصابة بفيروس نقص المناعة البشرية هي هزيمة جميع الروابط الرئيسية للجهاز المناعي. يصبح هؤلاء المرضى عاجزين ضد مجموعة واسعة من الكائنات الحية الدقيقة. وهذا يؤدي إلى تطور العدوى الانتهازية والأورام. بالنسبة للمرضى المصابين بعدوى فيروس نقص المناعة البشرية، يزداد خطر الإصابة بثلاثة أنواع على الأقل من السرطان: ساركوما كابوزي؛ السرطانة (بما في ذلك سرطان الجلد)؛ لمفوما الخلايا البائية، والتي تحدث بسبب التحول الخبيث للخلايا الليمفاوية البائية. ومع ذلك، فإن فيروس نقص المناعة البشرية ليس موجهًا للخلايا الليمفاوية فحسب، بل موجهًا للأعصاب أيضًا. يخترق خلايا الجهاز العصبي المركزي (الخلايا النجمية) عن طريق البلعمة بوساطة المستقبلات وعن طريق بلعمة الخلايا الليمفاوية المصابة بالفيروس بواسطة الخلايا النجمية. عندما يتفاعل الفيروس مع الخلايا النجمية، تتشكل أيضًا الخلايا الليمفاوية المتماثلة، مما يسهل انتشار العامل الممرض عبر القنوات بين الخلايا. يمكن للفيروس أن يبقى في الخلايا البلعمية والوحيدات لفترة طويلة، مما يجعلها بمثابة مستودع وموزع له في الجسم، حيث تتمكن من اختراق جميع الأنسجة. تلعب الخلايا البلعمية المصابة دورًا رئيسيًا في دخول فيروس نقص المناعة البشرية إلى الجهاز العصبي المركزي وإحداث تلف فيه. في 10% من المرضى، ترتبط المتلازمات السريرية الأولية بتلف الجهاز العصبي المركزي، وتتجلى في شكل خرف. وبالتالي، يُصنف المصابون بفيروس نقص المناعة البشرية إلى ثلاث مجموعات من الأمراض: العدوى الانتهازية،أمراض الأورام وتلف الجهاز العصبي المركزي.
علم الأوبئة لعدوى فيروس نقص المناعة البشرية
مصدر عدوى فيروس نقص المناعة البشرية هو الشخص فقط - سواء كان مريضًا أو حاملًا للفيروس. يوجد فيروس نقص المناعة البشرية (HIV) في الدم، والحيوانات المنوية، وسوائل عنق الرحم؛ وفي حليب الأم المرضعة. تنتقل العدوى جنسيًا، من خلال الدم ومكوناته، وكذلك من الأم إلى الطفل قبل الولادة وأثناءها وبعدها. لا توجد حالات إصابة بالفيروس عن طريق الطعام والشراب ولدغات الحشرات.
يساهم إدمان المخدرات في انتشار الإيدز. ويتزايد معدل الإصابة بفيروس نقص المناعة البشرية سنويًا. ووفقًا لمنظمة الصحة العالمية، أُصيب 58 مليون شخص بفيروس نقص المناعة البشرية بين عامي 1980 و2000. وفي عام 2000 وحده، أُصيب 5.3 مليون شخص حول العالم، وتوفي 3 ملايين شخص بسبب الإيدز. وحتى 1 يناير 2004، سُجِّل 264 ألف شخص مصاب بفيروس نقص المناعة البشرية في روسيا. ويموت نصف المصابين بالفيروس خلال 11-12 عامًا من لحظة الإصابة. في بداية عام 2004، كان حوالي 180 شخصًا من كل 100 ألف مواطن روسي مصابين بفيروس نقص المناعة البشرية. ومن المتوقع أنه مع هذا المستوى من الاعتلال، سيصل إجمالي عدد المصابين بفيروس نقص المناعة البشرية في روسيا بحلول عام 2012 إلى ما بين 2.5 و3 ملايين شخص. ويعتمد تعقيد مكافحة عدوى فيروس نقص المناعة البشرية على عدد من الأسباب: أولًا، لا توجد طرق فعالة لعلاجه والوقاية منه بشكل خاص؛ ثانيًا، قد تتجاوز فترة حضانة الإصابة بفيروس نقص المناعة البشرية 10 سنوات. وتعتمد مدتها على لحظة تنشيط الخلية اللمفاوية التائية والفيروس المسبب للمرض الموجود في كروموسومها. ولا يزال من غير الواضح ما إذا كان كل مصاب بالفيروس محكومًا عليه بالإصابة بالإيدز، أو ما إذا كان من الممكن حمل الفيروس على المدى الطويل دون الإصابة بالمرض (وهو أمر يبدو مستبعدًا). وأخيرًا، هناك العديد من فيروسات نقص المناعة البشرية (HIV-1 وHIV-2)، والتي تمنع الاختلافات المستضدية بينها تكوين المناعة المتصالبة. وقد ألقى اكتشاف فيروس نقص المناعة القردي (SIV) الضوء على مسألة أصل فيروس نقص المناعة البشرية. يتشابه SIV مع فيروس نقص المناعة البشرية في تنظيم جينومه، ولكنه يختلف اختلافًا كبيرًا في تسلسل النيوكليوتيدات. ويحتل فيروس نقص المناعة البشرية 2 موقعًا وسيطًا بين فيروس نقص المناعة البشرية 1 وSIV في خصائصه المصلية، وهو أقرب إلى SIV في تسلسل النيوكليوتيدات. وفي هذا الصدد، اقترح VM Zhdanov أن فيروسات HIV-1 وHIV-2 وSIV نشأت من سلف مشترك. ومن الممكن، وفقا لـ R. Gallo، أن يكون أحد فيروسات نقص المناعة البشرية قد دخل بطريقة ما إلى جسم الإنسان، حيث خضع لسلسلة من الطفرات، مما أدى إلى ظهور فيروس نقص المناعة البشرية 1، وفيروس نقص المناعة البشرية 2 وأشكاله الأخرى.
أعراض الإصابة بفيروس نقص المناعة البشرية
يتميز فيروس نقص المناعة البشرية ببعض الخصائص التي تُحدد بشكل كبير آلية المرض. يتميز الفيروس بمعدل تكاثر مرتفع للغاية، تحدده عناصره التنظيمية (يتم تصنيع ما يصل إلى 5000 فيريون في 5 دقائق في المرحلة النشطة). بفضل وجود بروتين الاندماج (gp41)، يُحفز الفيروس تكوين هياكل متزامنة واسعة النطاق نتيجة اندماج الخلايا التائية المساعدة المصابة وغير المصابة، مما يؤدي إلى موتها الجماعي. تتدفق جزيئات بروتين gpl20، المتكونة بكميات كبيرة، بحرية في الدم وترتبط بمستقبلات الخلايا التائية المساعدة غير المصابة، ونتيجة لذلك يتم التعرف عليها أيضًا وتدميرها بواسطة الخلايا التائية القاتلة. يمكن أن ينتشر الفيروس عبر القنوات بين الخلايا من خلية إلى أخرى، وفي هذه الحالة يصعب على الأجسام المضادة الوصول إليه.
المعايير السريرية لعدوى فيروس نقص المناعة البشرية
عند البالغين، تُشخَّص الإصابة بفيروس نقص المناعة البشرية عند ظهور عرضين خطيرين على الأقل، بالإضافة إلى عرض بسيط واحد على الأقل، وفي غياب أسباب أخرى معروفة لنقص المناعة (السرطان، نقص المناعة الخلقي، الجوع الشديد، إلخ). تشمل الأعراض الخطيرة ما يلي:
- فقدان الوزن بنسبة 10% أو أكثر؛
- حالة حمى طويلة الأمد، متقطعة أو مستمرة؛
- الإسهال المزمن.
الأعراض البسيطة: سعال مستمر، التهاب جلد معمم، هربس نطاقي متكرر، داء المبيضات الفموي والبلعومي، هربس بسيط مزمن، تضخم عقد لمفية معمم. يُشخَّص الإيدز فقط بوجود ساركوما كابوزي، والتهاب السحايا بالمكورات العقدية، والالتهاب الرئوي بالمتكيسة الرئوية. تتأثر الصورة السريرية للمرض بالعدوى الانتهازية المصاحبة.
طرق زراعة فيروس نقص المناعة البشرية (HIV)
يمكن زراعة فيروسي HIV-1 وHIV-2 في خلايا نسخة واحدة فقط من الخلايا الليمفاوية TCV4 - H9، المأخوذة من الخلايا الليمفاوية TCV4 المصابة بسرطان الدم. كما يمكن استخدام مزارع أحادية الطبقة من الخلايا النجمية، التي يتكاثر فيها فيروس HIV-1 بشكل جيد، لهذه الأغراض. الشمبانزي عرضة للإصابة بفيروس HIV-1 بين الحيوانات.
مقاومة الفيروس في البيئة الخارجية ضعيفة. يموت الفيروس تحت تأثير أشعة الشمس والأشعة فوق البنفسجية، ويتحلل عند درجة حرارة 80 درجة مئوية خلال 30 دقيقة، وعند معالجته بالمطهرات الشائعة، يستغرق الأمر من 20 إلى 30 دقيقة. لتطهير المواد التي تحتوي على الفيروس، من الضروري استخدام مطهرات مضادة للبكتيريا، نظرًا لفعاليتها ضد الكائنات الدقيقة ذات المقاومة العالية.
التشخيص المختبري لعدوى فيروس نقص المناعة البشرية
الطريقة الرئيسية لتشخيص حمل الفيروس والإصابة بفيروس نقص المناعة البشرية هي المقايسة المناعية الإنزيمية. ومع ذلك، نظرًا لتشابه gpl20 في بنيته ومولداته مع مستقبلات بعض الخلايا البشرية، بما في ذلك مستقبلات نقل الغلوبولينات المناعية عبر الخلايا الظهارية للأغشية المخاطية، فقد تظهر أجسام مضادة مرتبطة بأجسام مضادة لـ gpl20 في الجسم. في هذه الحالة، قد تكون نتائج ELISA إيجابية كاذبة. لذلك، تخضع جميع عينات المصل المتفاعلة إيجابيًا من الأشخاص لتحليل إضافي باستخدام طريقة التهجين المناعي، أو التهجين الغربي. تعتمد هذه الطريقة على تحديد الأجسام المضادة قيد الدراسة بعد فصلها بالرحلان الكهربائي، ثم اختبارها باستخدام أجسام مضادة مُعَلَّمة للأنواع. نادرًا ما تُستخدم الطريقة الفيروسية نظرًا لتعقيد زراعة الفيروس. تُستخدم استنساخة الخلايا الليمفاوية H9 للحصول على مستضدات فيروسية، وهي المكونات الضرورية لأنظمة الاختبار التشخيصي. تتيح طريقة CPR الكشف عن الفيروس في مرحلة مبكرة من الإصابة بالفيروس في الدم.
علاج عدوى فيروس نقص المناعة البشرية
من الضروري إيجاد أو تصنيع أدوية تُثبِّط بفعالية نشاط إنزيم النسخ العكسي (ريفرتاز) أو البروتياز الفيروسي. تمنع هذه الأدوية تكوين الحمض النووي الريبوزي منقوص الأكسجين (DNA) و/أو تُثبِّط تكاثر الفيروس داخل الخلايا. تعتمد الاستراتيجية الحديثة لعلاج مرضى فيروس نقص المناعة البشرية على مبدأ الاستخدام المشترك للأدوية التي تُثبِّط إنزيم البروتياز الفيروسي (أحد الأدوية) وإنزيم الفيركسيز (دواءان مختلفان) - أي العلاج المشترك (الثلاثي). في روسيا، يُوصى بالاستخدام المشترك لدواءين محليين لعلاج مرضى فيروس نقص المناعة البشرية: فوسفازيد وكريكسيفان، واللذان يُثبِّطان تكاثر فيروس نقص المناعة البشرية تحديدًا في المراحل المبكرة والمتأخرة من التكاثر، خاصةً مع انخفاض نشاط أزيدوثيميدين.
تكمن مشكلة الوقاية النوعية في الحاجة إلى تطوير لقاح يضمن تكوين مناعة خلوية فعالة، تعتمد على الخلايا الليمفاوية السامة للخلايا الخاصة بالفيروس، دون إنتاج كبير للأجسام المضادة. تُوفر هذه المناعة من خلال مساعدات Thl. من الممكن أن تكون الأجسام المضادة، بما في ذلك الأجسام المُحيِّدة للفيروس، غير فعالة في تثبيط عدوى فيروس نقص المناعة البشرية، بل إنها تُثبط المناعة الخلوية بدرجة كبيرة. لذلك، يجب أن يلبي أي لقاح مضاد لفيروس نقص المناعة البشرية، في المقام الأول، شرطين رئيسيين: أ) أن يكون آمنًا تمامًا، ب) أن يُحفِّز نشاط الخلايا الليمفاوية التائية السامة للخلايا. تُدرس فعالية مختلف أنواع اللقاحات المُستخلصة من الفيروسات المقتولة (المُعطَّلة) ومن مستضدات فردية ذات خصائص وقائية عالية. يمكن عزل هذه المستضدات من الفيروسات نفسها أو تصنيعها كيميائيًا. وقد طُرِح لقاح مُصنَّع باستخدام أساليب الهندسة الوراثية. وهو فيروس جدري الماء مُؤتلف يحمل جينات فيروس نقص المناعة البشرية المسؤولة عن تصنيع مستضدات ذات خصائص مناعية قوية. تتطلب مسألة فعالية هذه اللقاحات وقتًا طويلًا نظرًا لطول فترة حضانة الإصابة بفيروس نقص المناعة البشرية والتنوع الكبير في مسببات المرض. ويُعدّ تطوير لقاح فعال للغاية ضد فيروس نقص المناعة البشرية مشكلةً جوهريةً مُلحّة.

