منشورات جديدة
الطفرة الجينية ARID1A تجعل الأورام حساسة للعلاج المناعي
آخر مراجعة: 02.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.

أحدث العلاج المناعي ثورةً في علاج السرطان في السنوات الأخيرة. فبدلاً من استهداف الأورام مباشرةً، يُوجِّه العلاج المناعي أجهزة المناعة لدى المرضى لمهاجمتها بفعالية أكبر. وهذا فعالٌ بشكل خاص في بعض أنواع السرطان التي يصعب علاجها. ومع ذلك، لا يستجيب سوى أقل من نصف مرضى السرطان للعلاجات المناعية الحالية، مما يُولِّد حاجةً مُلِحّةً لتحديد المؤشرات الحيوية التي تُمكِّن من التنبؤ بالمرضى الأكثر استفادةً من العلاج.
لاحظ العلماء مؤخرًا أن المرضى الذين تعاني أورامهم من طفرة في جين ARID1A هم أكثر عرضة للاستجابة بشكل إيجابي لحصار نقطة التفتيش المناعية، وهو نوع من العلاج المناعي الذي يعمل عن طريق إبقاء الخلايا المناعية التي تحارب السرطان نشطة.
وبما أن طفرة جين ARID1A موجودة في العديد من أنواع السرطان، بما في ذلك سرطان بطانة الرحم والمبيض والقولون والمستقيم والمعدة والكبد والبنكرياس، فقد تساءل باحثو معهد سالك عن كيفية مساهمتها في حساسية العلاج وكيف يمكن للأطباء استخدام هذه المعلومات لتخصيص علاج السرطان لكل مريض.
وتُظهر دراستهم الجديدة، التي نُشرت في مجلة Cell ، أن طفرة ARID1A تجعل الأورام حساسة للعلاج المناعي من خلال تجنيد الخلايا المناعية المقاومة للسرطان إلى الورم من خلال استجابة مناعية تشبه تلك المضادة للفيروسات.
يقترح الباحثون إمكانية استخدام هذه الطفرة والاستجابة المناعية المضادة للفيروسات كمؤشر حيوي لاختيار المرضى بشكل أفضل لعلاجات مناعية محددة، مثل حصار نقاط التفتيش المناعية. كما تشجع هذه النتائج على تطوير أدوية تستهدف بروتين ARID1A والبروتينات ذات الصلة لجعل الأورام الأخرى أكثر حساسية للعلاج المناعي.
قالت الأستاذة المساعدة ديانا هارجريفز، المؤلفة الرئيسية للدراسة: "قد يُحدث هذا تغييرًا جذريًا في نتائج علاج السرطان لدى المرضى. يمتلك المرضى المصابون بطفرة ARID1A استجابة مناعية بالفعل، لذا كل ما نحتاجه هو تعزيز هذه الاستجابة بحصار نقاط التفتيش المناعية لمساعدتهم على تدمير أورامهم من الداخل".
على الرغم من أنه كان معروفًا أن الأشخاص الذين يحملون طفرات ARID1A يستجيبون جيدًا لحصار نقاط التفتيش المناعية، إلا أن الصلة الدقيقة بينهما ظلت غير واضحة. ولتوضيح الآلية، استخدم علماء معهد سالك نماذج فئران لسرطان الجلد وسرطان القولون والمستقيم مع كل من طفرة ARID1A وجين ARID1A الوظيفي.
المصدر: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
لاحظ الفريق استجابة مناعية قوية في جميع النماذج التي تحمل طفرة ARID1A، ولكن ليس في النماذج التي كان فيها ARID1A فعالاً، مما يدعم فكرة أن طفرة ARID1A هي بالفعل المحرك لهذه الاستجابة. ولكن كيف يعمل هذا على المستوى الجزيئي؟
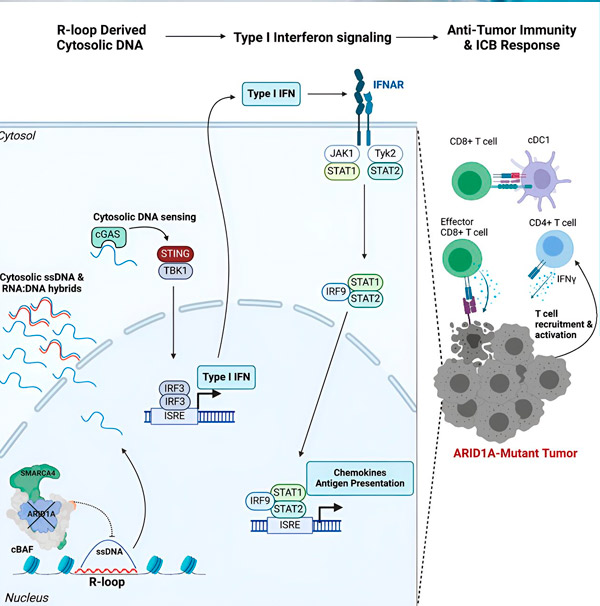
يقول ماثيو ماكسويل، المؤلف الرئيسي للدراسة وطالب الدراسات العليا في مختبر هارجريفز: "وجدنا أن ARID1A يلعب دورًا هامًا في النواة من خلال الحفاظ على تنظيم الحمض النووي بشكل سليم. فبدون ARID1A الفعال، يمكن استئصال الحمض النووي الحر وإطلاقه في السيتوزول، مما يُنشّط استجابة مناعية مضادة للفيروسات مرغوبة، والتي يمكن تعزيزها عن طريق حصار نقطة التفتيش المناعية".
يُشفِّر جين ARID1A بروتينًا يُساعد على تنظيم شكل الحمض النووي لدينا والحفاظ على استقرار الجينوم. عندما يتحور هذا الجين، يُطلق سلسلة من الأحداث تُشبه روب غولدبرغ في الخلايا السرطانية.
أولاً، يؤدي نقص بروتين ARID1A الفعال إلى إطلاق الحمض النووي في السيتوزول. ثم يُفعّل الحمض النووي في السيتوزول نظام إنذار مضاد للفيروسات، وهو مسار cGAS-STING، لأن خلايانا مُهيأة لتمييز أي حمض نووي في السيتوزول على أنه غريب للحماية من العدوى الفيروسية. في النهاية، يُفعّل مسار cGAS-STING الجهاز المناعي لتجنيد الخلايا التائية إلى الورم وتنشيطها لتصبح خلايا تائية متخصصة في قتل السرطان.
في كل خطوة، وبناءً على الخطوة السابقة، تؤدي سلسلة الأحداث هذه - طفرة ARID1A، وتسرب الحمض النووي، وإنذار cGAS-STING، وتجنيد الخلايا التائية - إلى زيادة عدد الخلايا التائية المُكافحة للسرطان في الورم. ويمكن بعد ذلك استخدام حصار نقطة التفتيش المناعية لضمان استمرار نشاط هذه الخلايا التائية، مما يُعزز قدرتها على هزيمة السرطان.
يقول هارجريفز: "تُقدم نتائجنا آلية جزيئية جديدة يُمكن من خلالها لطفرة ARID1A أن تُساهم في استجابة مناعية مضادة للأورام. والأمر المثير للاهتمام في هذه النتائج هو قدرتها على الانتقال إلى علاجات أخرى. يُمكننا استخدام طفرات ARID1A لاختيار مرضى لاستهداف نقاط التفتيش المناعية، ونرى الآن آليةً يُمكن من خلالها استخدام الأدوية المُثبطة لـ ARID1A أو مُركب بروتينه لتعزيز العلاج المناعي لدى مرضى آخرين".
من خلال وصف آلية زيادة فعالية حصار نقاط التفتيش المناعية في السرطانات المتحولة بجين ARID1A، يُقدّم الباحثون للأطباء مبررًا لإعطاء الأولوية لهذا العلاج المناعي للمرضى المصابين بطفرة في هذا الجين. تُمثّل هذه النتائج خطوةً مهمةً نحو تخصيص علاج السرطان، وتُلهم تطوير علاجات جديدة تستهدف ARID1A ومركبه البروتيني.
ويأمل فريق معهد سالك أن تؤدي نتائجهم في المستقبل إلى تحسين نتائج العلاج للمرضى الذين يعانون من أنواع مختلفة من السرطان المرتبطة بطفرات ARID1A، ويعتزمون استكشاف هذا الترجمة السريرية بالتعاون مع جامعة كاليفورنيا في سان دييغو.
