تؤدي مشتقات الثاليدومايد إلى موت الخلايا السرطانية المقاومة
آخر مراجعة: 14.06.2024

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
تشير دراسة أجرتها جامعة جوته في فرانكفورت إلى احتمال أن تكون مشتقات الثاليدومايد مناسبة لعلاج السرطان. في الخمسينيات من القرن الماضي، تم بيع الثاليدومايد كحبوب منومة. واشتهر لاحقًا بإحداث تشوهات خطيرة للجنين في المراحل الأولى من الحمل.
من المعروف أيضًا أن الجزيء يحدد البروتينات الموجودة في الخلية لتدميرها. وكجزء من البحث الحالي، ابتكر العلماء مشتقات من الثاليدومايد. وتمكنوا من إثبات أن هذه المواد تؤثر على تدمير البروتينات المسؤولة عن بقاء الخلايا السرطانية.
ربما لا يوجد جزيء آخر له مثل هذا الماضي المضطرب مثل الثاليدومايد. لقد كان المكون الرئيسي لدواء تمت الموافقة عليه في العديد من البلدان في الخمسينيات من القرن الماضي باعتباره مسكنًا ومنومًا. ومع ذلك، سرعان ما أصبح واضحًا أن النساء الحوامل اللاتي يتناولن الثاليدومايد غالبًا ما يلدن أطفالًا يعانون من تشوهات خطيرة.
ومع ذلك، في العقود الأخيرة، وضع الطب آمالًا كبيرة عليه مرة أخرى. وقد أظهرت الأبحاث، من بين أمور أخرى، أنها تمنع نمو الأوعية الدموية وبالتالي فهي مناسبة لقطع الأورام عن وسطها الغذائي. ثم أثبت أيضًا فعاليته الكبيرة في علاج المايلوما المتعددة، وهي أورام خبيثة في نخاع العظم.
يشرح الدكتور شينغلاي تشنغ من معهد الكيمياء الصيدلانية بجامعة جوته في فرانكفورت: "نحن نعلم الآن أنه يمكن تسمية الثاليدومايد بـ "الغراء الجزيئي". "وهذا يعني أنه قادر على التقاط بروتينين والجمع بينهما."
وهذا مثير للاهتمام بشكل خاص لأن أحد هذه البروتينات هو نوع من "آلة وضع العلامات": فهو يربط علامة "TRASH" لا لبس فيها ببروتين آخر.
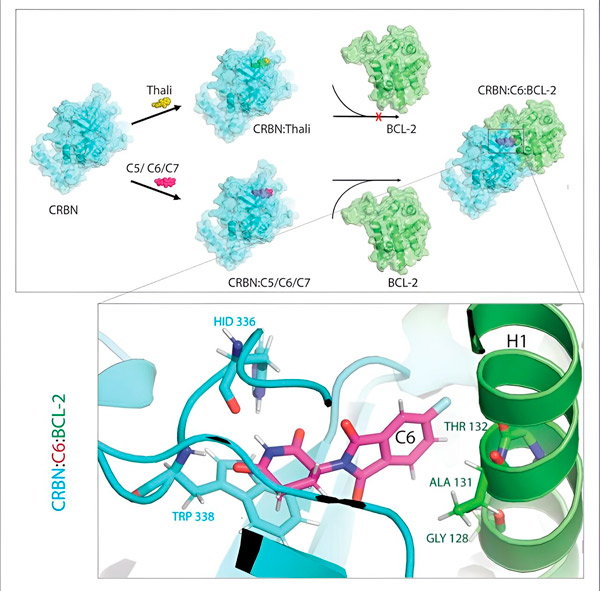
تقوم مشتقات الثاليدومايد C5 وC6 وC7 بتعديل CRBN، "آلة وضع العلامات"، بحيث يمكن الارتباط بـ BCL-2. وهكذا، فإن جزيء BCL-2 يتميز بالتحلل، وهي استراتيجية جديدة محتملة لمكافحة السرطان. المؤلف: د. شينغلاي تشينغ
يتعرف نظام التخلص من النفايات في الخلية على هذه العلامة: فهو يلتقط جزيء البروتين المسمى ويمزقه. يقول تشينغ: "إن هذه الآلية هي التي تشرح التأثيرات المختلفة للثاليدومايد". "اعتمادًا على البروتين الذي تم وضع علامة عليه، يمكن أن يؤدي ذلك إلى تشوهات أثناء التطور الجنيني أو إلى تدمير الخلايا الخبيثة."
توفر هذه الآلية وعدًا طبيًا كبيرًا لأن الخلايا السرطانية تعتمد على بروتينات معينة للبقاء على قيد الحياة. وإذا أمكن استهدافهم وتمزيقهم بشكل منهجي، فقد يتم علاج المرض. المشكلة هي أن الغراء الجزيئي غريب جدًا.
أحد شركاء الربط هو دائمًا آلة وضع علامات على الخلايا، أو باللغة العلمية، إنزيم E3 يسمى CRBN. فقط عدد قليل جدًا من آلاف البروتينات الموجودة في الجسم يمكن أن يكون شريكًا ثانيًا - والتي تعتمد على الغراء.
"لذلك قمنا بإنشاء سلسلة من مشتقات الثاليدومايد"، كما يقول تشنغ. "ثم قمنا بالتحقق مما إذا كان لديهم خصائص لاصقة، وإذا كان الأمر كذلك، ما هي البروتينات التي كانت فعالة ضدها." وللقيام بذلك، أضاف الباحثون مشتقاتهم إلى جميع البروتينات الموجودة في خط الخلايا النامية. ثم لاحظوا أيًا من هذه البروتينات يتحلل بعد ذلك في وجود CRBN.
"في هذه العملية، حددنا ثلاثة مشتقات يمكنها تمييز البروتين الخلوي المهم جدًا للتحلل، BCL-2"، يوضح تشنغ. "يمنع BCL-2 الخلايا من تفعيل برنامج التدمير الذاتي الخاص بها، فإذا فقده تموت الخلايا."
لذلك كان BCL-2 محور أبحاث السرطان لفترة طويلة. يوجد بالفعل دواء لسرطان الدم يسمى venetoclax، والذي يقلل من فعالية BCL-2 وبالتالي يتسبب في تدمير الخلايا المتحورة ذاتيًا.
"ومع ذلك، في العديد من الخلايا السرطانية، يحدث طفرة في BCL-2 نفسه. ونتيجة لذلك، لم يعد فينيتوكلاكس يثبط البروتين"، كما يقول تشينغ. "لقد تمكنا من إظهار أن مشتقاتنا تشير أيضًا إلى هذا الشكل المتحور للتحلل. بالإضافة إلى ذلك، قام شركاؤنا في معهد ماكس بلانك للفيزياء الحيوية بمحاكاة تفاعل مشتقات الثاليدوميد مع BCL-2 على الكمبيوتر. وأظهر هذا أن المشتقات ترتبط بـ BCL-2". مواقع مختلفة تمامًا عن الفينيتوكلاكس - وهي نتيجة تمكنا أيضًا لاحقًا من تأكيدها تجريبيًا."
بالإضافة إلى ذلك، قام الباحثون باختبار موادهم على ذباب الفاكهة المصاب بالخلايا السرطانية. وكان معدل البقاء على قيد الحياة للذباب المعالج بهذه الطريقة أعلى بكثير. ومع ذلك، يحذر تشينغ من المبالغة في الحماس، لأن هذه النتائج لا تزال بحثًا أساسيًا. "على الرغم من أنها تظهر أن جزيئات الثاليدومايد المعدلة لها إمكانات علاجية كبيرة، إلا أننا لا نستطيع أن نقول بعد ما إذا كانت ستثبت نفسها في الممارسة العملية في أي وقت من الأوقات."
تم نشر نتائج الدراسة في مجلة Cell Reports Physical Science.
