منشورات جديدة
توضيح الآليات الخلوية لالتهاب دواعم الأسنان باستخدام نموذج حيواني محسّن
آخر مراجعة: 02.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
قام باحثون من جامعة طوكيو للطب وطب الأسنان بتطوير تقنية تسمح بتحليل مفصل لتطور التهاب دواعم الأسنان بمرور الوقت.
يُعدّ مرض دواعم الأسنان، المعروف بالتهاب دواعم الأسنان ، السبب الرئيسي لفقدان الأسنان، إذ يصيب ما يقارب واحدًا من كل خمسة بالغين حول العالم. في معظم الحالات، تنجم هذه الحالة عن استجابة التهابية لعدوى بكتيرية في الأنسجة المحيطة بالأسنان.
مع تفاقم الحالة، تبدأ اللثة بالانحسار، كاشفةً عن جذور الأسنان والعظام. والجدير بالذكر أن معدل الإصابة بالتهاب دواعم الأسنان يزداد مع التقدم في السن، ومع ازدياد متوسط أعمار سكان العالم، من المهم فهم أسبابه وتطوره فهمًا دقيقًا.
وفي دراسة نشرت في مجلة Nature Communications ، وجد باحثون من جامعة TMDU طريقة لتحقيق هذا الهدف من خلال تحسين نموذج حيواني يستخدم على نطاق واسع لدراسة التهاب دواعم السن.
من الصعب دراسة التهاب دواعم السن لدى البشر مباشرةً. ولذلك، يلجأ العلماء غالبًا إلى نماذج حيوانية لإجراء دراسات ما قبل السريرية. على سبيل المثال، مكّن "نموذج الفأر لالتهاب دواعم السن المُستحث بالربط" الباحثين من دراسة الآليات الخلوية الكامنة وراء هذه الحالة منذ طرحه عام ٢٠١٢.
ببساطة، يُحدث هذا النموذج أمراض اللثة اصطناعيًا عن طريق وضع خيوط حريرية على أضراس الفئران، مما يؤدي إلى تراكم اللويحات السنية. ورغم سهولة وفعالية هذه الطريقة، إلا أنها لا تُغطي الصورة الكاملة لالتهاب دواعم الأسنان.
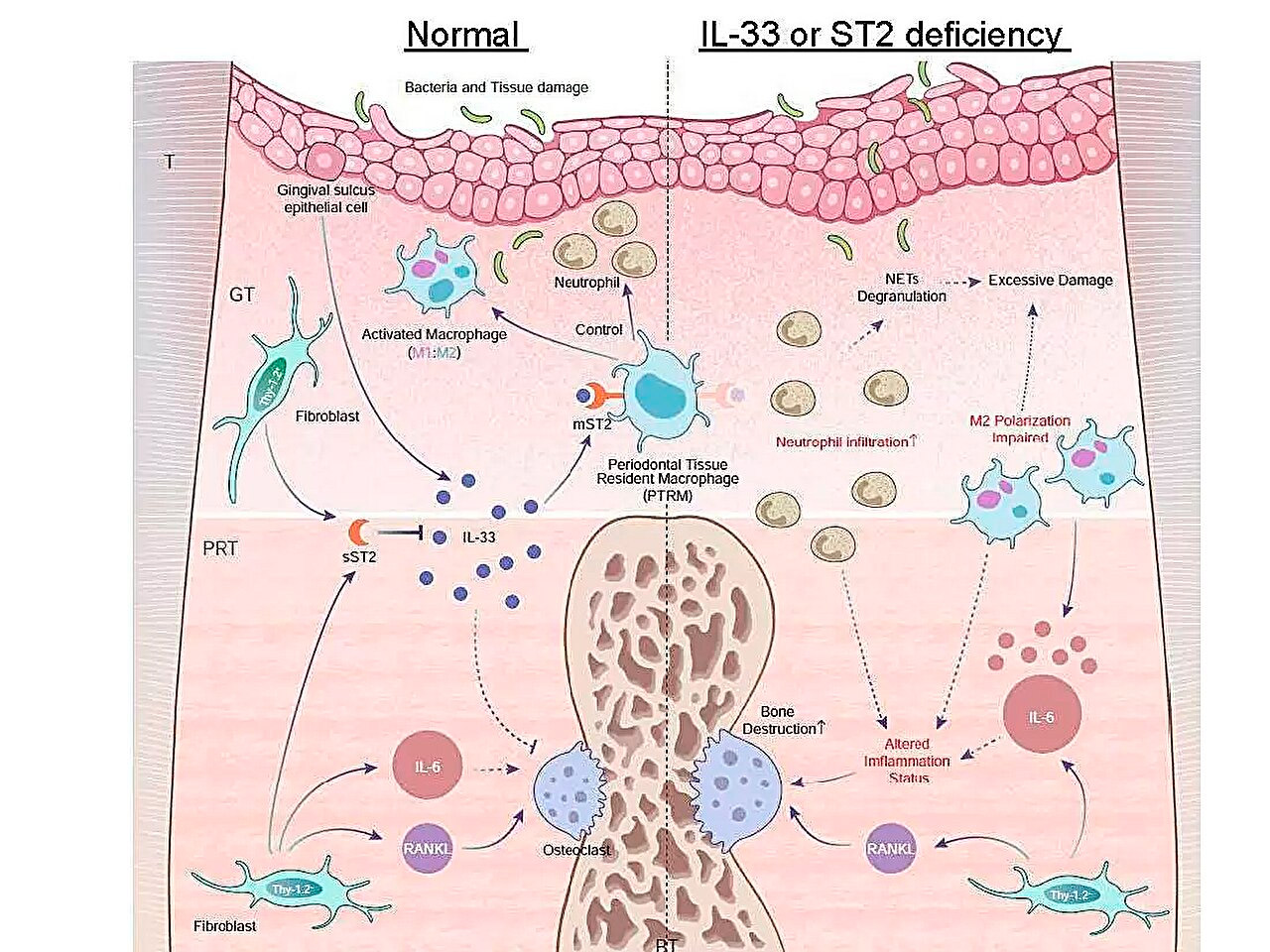
رسم تخطيطي لأنماط التعبير الجيني الالتهابي أثناء التهاب دواعم السن ودور محور IL-33/ST2 في مكافحة الالتهاب الحاد. المصدر: جامعة طوكيو للطب وطب الأسنان.
على الرغم من أن أنسجة دواعم السن تتكون من اللثة، والرباط اللثوي، والعظم السنخي، والملاط، إلا أن التحليل يُجرى عادةً على عينات اللثة فقط نظرًا للقيود التقنية والكمية، كما يشير الباحث الرئيسي في الدراسة أنهاو ليو. "هذه الاستراتيجية في أخذ العينات تحد من الاستنتاجات التي يمكن استخلاصها من هذه الدراسات، لذا يلزم وجود أساليب تسمح بتحليل جميع مكونات الأنسجة في وقت واحد."
لمعالجة هذا النقص، طوّر فريق البحث نموذجًا معدّلًا لالتهاب دواعم السنّ المُستحثّ بالربط. فبدلًا من الربطة المفردة التقليدية، استخدموا ربطة ثلاثية على الضرس العلوي الأيسر لذكور الفئران. وقد وسّع هذا النموذج مساحة فقدان العظم دون إتلاف العظم المحيط بالضرس الثاني بشكل كبير، مما زاد من عدد أنواع أنسجة دواعم السنّ المختلفة.
"عزلنا ثلاثة أنواع رئيسية من الأنسجة، وقيّمنا إنتاج الحمض النووي الريبوزي بين النموذجين. أظهرت النتائج أن النموذج الثلاثي الربط زاد الإنتاج بفعالية، محققًا أربعة أضعاف كمية الأنسجة المحيطة بالجذر الطبيعية، داعمًا بذلك تحليلًا عالي الدقة لأنواع مختلفة من الأنسجة"، يوضح الدكتور ميكيهيتو هاياشي، المؤلف الرئيسي للدراسة.
بعد التأكد من فعالية نموذجهم المعدل، شرع الباحثون في دراسة تأثيرات التهاب دواعم السن على التعبير الجيني عبر أنواع مختلفة من الأنسجة بمرور الوقت، مع التركيز على الجينات المرتبطة بالالتهاب وتمايز الخلايا الناقضة للعظم.
كان من أهم نتائجهم أن التعبير عن جين Il1rl1 كان أعلى بكثير في النسيج المحيط بالجذر بعد خمسة أيام من عملية الربط. يُشفّر هذا الجين بروتين ST2 في أشكال مستقبلات ومُضادة، والتي ترتبط بسيتوكين يُسمى IL-33، وهو مُشارك في العمليات الالتهابية والتنظيم المناعي.
لمزيد من التعمق في دور هذا الجين، حفّز الفريق التهاب دواعم السن لدى فئران معدلة وراثيًا تفتقر إما إلى جينات Il1rl1 أو Il33. أظهرت هذه الفئران تلفًا عظميًا التهابيًا متسارعًا، مما يُبرز الدور الوقائي لمسار IL-33/ST2. وكشف تحليل إضافي للخلايا التي تحتوي على بروتين ST2 في شكله المستقبلي، mST2، أن معظمها نشأ من الخلايا البلعمية.
تُصنف الخلايا البلعمية عمومًا إلى نوعين رئيسيين: مُحفِّزة للالتهابات ومضادة لها، وذلك حسب نشاطها. وقد وجدنا أن الخلايا المُعبِّرة عن mST2 فريدة من نوعها، إذ إنها تُعبِّر في الوقت نفسه عن بعض علامات كلا النوعين من الخلايا البلعمية، كما علق الدكتور تاكانوري إيواتا، الباحث الرئيسي في الدراسة. وأضاف: "كانت هذه الخلايا موجودة في النسيج المحيط بالجذر قبل بدء الالتهاب، لذلك أطلقنا عليها اسم "الخلايا البلعمية المقيمة في أنسجة اللثة"."
وبشكل عام، تظهر نتائج هذه الدراسة قوة نموذج حيواني معدّل لدراسة التهاب دواعم السن على نطاق أكثر تفصيلاً، وصولاً إلى المستوى الجزيئي الحيوي.
نقترح إمكانية إيجاد مسار جزيئي جديد للإنترلوكين-33/ST2 يُنظّم الالتهاب وتدمير العظام في أمراض اللثة، إلى جانب خلايا بلعمية محددة في الأنسجة المحيطة بالجذر السنّي، والتي تُشارك بشكل كبير في أمراض اللثة. ونأمل أن يُؤدي هذا إلى تطوير استراتيجيات علاجية جديدة وطرق وقائية، كما خلص الباحث الرئيسي الدكتور توموكي ناكاشيما.
