منشورات جديدة
تنشيط المناعة الفطرية: جزء مهم من الآلية التي تم تحديدها
آخر مراجعة: 02.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
نجح باحثون من جامعة لويولا ماريماونت في فك شفرة التفاعل المعقد بين العديد من الإنزيمات حول مستقبل المناعة الفطري Toll-like receptor 7 (TLR7)، والذي يلعب دورًا مهمًا في حماية أجسامنا من الفيروسات.
يلعب مستقبل TLR7، الموجود على الخلايا الشجيرية في جهازنا المناعي، دورًا حاسمًا في دفاعنا الطبيعي ضد الفيروسات. يتعرف TLR7 على الحمض النووي الريبوزي الفيروسي أحادي السلسلة وغيره من الحمض النووي الريبوزي الغريب، وينشط إطلاق وسطاء الالتهاب. كما يلعب خلل هذا المستقبل دورًا رئيسيًا في أمراض المناعة الذاتية، مما يزيد من أهمية فهم آلية تنشيط TLR7، بل وتعديلها في أفضل الأحوال.
تمكن الباحثون، بقيادة البروفيسور فيت هورنونج ومارلين بيروتي من مركز ميونيخ لعلم الوراثة وقسم الكيمياء الحيوية بجامعة لويولا ماريماونت، من التعمق في آلية التنشيط المعقدة. وكانت دراسات سابقة قد أشارت إلى ضرورة قطع جزيئات الحمض النووي الريبوزي المعقدة ليتمكن المستقبل من التعرف عليها.
باستخدام مجموعة من التقنيات، من علم الأحياء الخلوي إلى المجهر الإلكتروني المبرد، اكتشف باحثو جامعة لويولا ماريماونت كيفية معالجة الحمض النووي الريبي الغريب أحادي السلسلة للكشف عن TLR7. نُشر عملهم في مجلة Immunity.
هناك العديد من الإنزيمات التي تشارك في التعرف على الحمض النووي الريبي الغريب
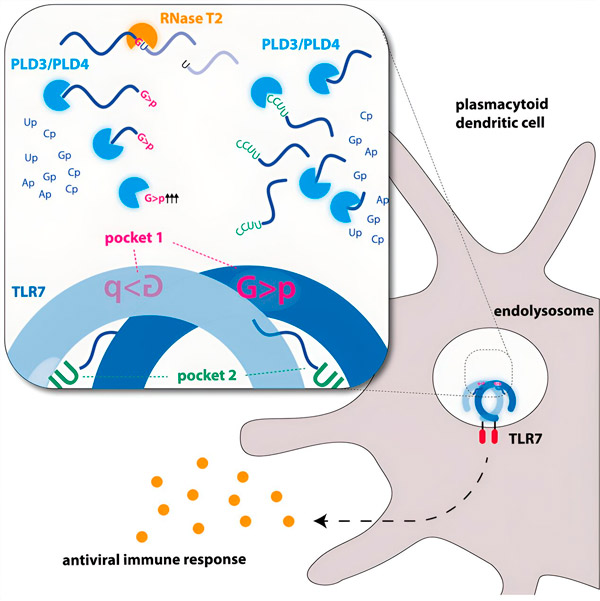
على مدار التطور، تخصص الجهاز المناعي في التعرف على مسببات الأمراض من خلال مادتها الوراثية. على سبيل المثال، يُحفَّز مستقبل المناعة الفطري TLR7 بواسطة الحمض النووي الريبوزي الفيروسي (RNA). يمكننا اعتبار الحمض النووي الريبوزي الفيروسي خيوطًا طويلة من الجزيئات، كبيرة الحجم جدًا بحيث لا يمكن التعرف عليها كربيطات لمستقبل TLR7. وهنا يأتي دور النوكليازات، وهي أدوات تقطيع جزيئية تقطع "خيط الحمض النووي الريبوزي" إلى قطع صغيرة.
تقطع النوكليازات الداخلية جزيئات الحمض النووي الريبوزي من المنتصف، كما لو كانت مقصًا، بينما تشق النوكليازات الخارجية الشريط من أحد طرفيه إلى الطرف الآخر. تُولّد هذه العملية شظايا مختلفة من الحمض النووي الريبوزي، والتي يمكنها الآن الارتباط بجيبين مختلفين على مستقبل TLR7. فقط عندما يكون كلا جيبي الارتباط على المستقبل مشغولين بقطع الحمض النووي الريبوزي هذه، يتم إطلاق سلسلة إشارات تُنشّط الخلية وتُطلق حالة إنذار.
صورة توضيحية. المصدر: Immunity (2024). DOI: 10.1016/j.immuni.2024.04.010
وجد الباحثون أن التعرف على الحمض النووي الريبوزي لـ TLR7 يتطلب نشاط إنزيم النوكلياز الداخلي RNase T2، الذي يعمل بالتزامن مع إنزيمي النوكلياز الخارجيين PLD3 وPLD4 (فوسفوليباز D3 وD4). يقول هورنونغ: "في حين كان معروفًا أن هذه الإنزيمات قادرة على تحلل الحمض النووي الريبوزي، فقد أثبتنا الآن أنها تتفاعل مع TLR7، وبالتالي تُنشّطه".
موازنة الجهاز المناعي
وجد الباحثون أيضًا أن نوكليازات PLD تلعب دورًا مزدوجًا في الخلايا المناعية. ففي حالة TLR7، يكون لها تأثير مُحفِّز للالتهابات، بينما في حالة مستقبل TLR9، وهو مستقبل TLR آخر، يكون لها تأثير مُضاد للالتهابات. ويوضح بيروتي: "يشير هذا الدور المزدوج لنوكليازات PLD إلى توازن دقيق للتحكم في الاستجابات المناعية السليمة".
قد يُشكّل التحفيز والتثبيط المتزامن للالتهاب بواسطة هذه الإنزيمات آلية وقائية مهمة لمنع أي خلل في وظائف الجسم. أما الدور الذي قد تلعبه الإنزيمات الأخرى في مسار الإشارة هذا، وما إذا كانت الجزيئات المعنية مناسبة كبنى مستهدفة للعلاج، فسيكون موضوعًا لمزيد من البحث.
