عقار LM11A-31 يبطئ تطور مرض الزهايمر في التجربة
آخر مراجعة: 14.06.2024

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.

في دراسة حديثة نشرت في مجلة Nature Medicine، أجرى الباحثون تجربة المرحلة 2 أ العشوائية، مزدوجة التعمية، الخاضعة للتحكم الوهمي لفحص سلامة وفعالية LM11A-31 في علاج مرض الزهايمر (AD) من خلال تعديل مستقبل البروتين العصبي p75 (p75NTR).
مرض الزهايمر المتأخر هو الشكل الأكثر شيوعًا من الخرف، والذي يتميز بفشل التشابك العصبي، وانحطاط وفقدان الخلايا العصبية. على الرغم من أن العقارين الرئيسيين لعلاج مرض الزهايمر يستهدفان تراكم بروتين الأميلويد بيتا أو بروتين تاو غير الطبيعي، إلا أنهما يعالجان جزءًا فقط من الفيزيولوجيا المرضية. هناك نهج آخر يتمثل في استهداف المستقبلات وشبكات الإشارات التي تؤثر على المسارات البيولوجية الأساسية. تظهر الدراسات قبل السريرية أن تعديل p75NTR مع الجزيء الصغير الجديد LM11A-31 يقلل من فقدان التشابك العصبي الناجم عن الأميلويد والتاو المرضي.
وصف الدراسة
في هذه التجربة السريرية العشوائية، قام الباحثون بفحص ما إذا كان LM11A-31 يمكنه إبطاء تطور مرض الزهايمر عن طريق تعديل p75NTR في البشر.
تم إعطاء المشاركين في الدراسة كبسولات فموية من LM11A-31 بجرعات 200 ملغ و400 ملغ أو دواء وهمي بنسبة 1:1:1 إلى 242 مريضًا يعانون من الربو الخفيف إلى المتوسط لمدة 26 أسبوعًا. أكد المشاركون بيولوجيًا مرض الزهايمر (مستوى بروتين أميلويد 42 (Aβ42) في السائل النخاعي أقل من 550 نانوغرام / لتر أو نسبة Aβ42:β40 أقل من 0.89)، وتم تشخيصهم وفقًا لمعايير ماكهان، مع درجات Mini Psychiatric SE (MMSE) من 18 إلى 26. درجات مقياس اكتئاب الشيخوخة (GDS) أقل من 5.0، ودرجات مقياس هاسينسكي الإقفاري المعدل (HIS) أقل من 4.0، والتعليم الرسمي ≥ 8 سنوات، والتدهور المعرفي السابق ≥ 6 أشهر.
كان المشاركون المؤهلون يتناولون مثبطات الأسيتيل كولينستريز (AChEIs) أو مضادات مستقبلات NMDA الجزئية قبل ≥ 3 أشهر من بدء الدراسة. لم يكونوا يتناولون أدوية غير مشروعة، مثل مضادات الذهان، والبنزوديازيبينات، والأدوية المضادة للصرع، والمهدئات، والأدوية الخافضة لضغط الدم النشطة مركزيًا، أو منشطات الذهن (باستثناء الجنكة بيلوبا) أو المسكنات التي تحتوي على المواد الأفيونية.
كانت النتيجة الأولية للدراسة هي سلامة الدواء وتحمله وفقًا لتقييم مقياس كولومبيا لتقييم خطورة الأفكار الانتحارية والسلوك (C-SSRS)، والعلامات الحيوية، وضغط الدم، والمعلمات الدموية. تم استخدام التصوير بالرنين المغناطيسي الهيكلي (sMRI)، والتصوير المقطعي بالإصدار البوزيتروني الفلوروديوكسي جلوكوز (FDG-PET)، والمؤشرات الحيوية للسائل النخاعي (CSF) لتقييم النتائج المعرفية الثانوية. تضمنت مؤشرات AD فسفرة تاو عند Thr181، وبروتين تاو الكلي، ونشاط Aβ40، وAβ42، وAChE. استخدم الفريق اختبارًا نفسيًا عصبيًا فرديًا لتقييم النتائج المعرفية الثانوية عند خط الأساس، الأسبوعين 12 و26.
نتائج البحث
وجدت الدراسة أن LM11A-31 كان آمنًا وجيد التحمل، مع عدم وجود مخاوف كبيرة تتعلق بالسلامة. وشملت الآثار الجانبية الأكثر شيوعًا الصداع والإسهال وفرط اليوزينيات والتهاب البلعوم الأنفي، وكانت مشاكل الجهاز الهضمي وفرط اليوزينيات هي الأسباب الرئيسية لوقف الدواء. كان هناك المزيد من التوقفات في مجموعة 400 ملغ مقارنة بمجموعتي 200 ملغ والعلاج الوهمي. لم يكشف التصوير بالرنين المغناطيسي عن أي مخاوف تتعلق بسلامة الدواء، بما في ذلك التشوهات المرتبطة بالأميلويد. لم تكن هناك فروق ذات دلالة إحصائية في الدرجات المعرفية أو تشوهات الأميلويد بين مجموعتي العلاج.
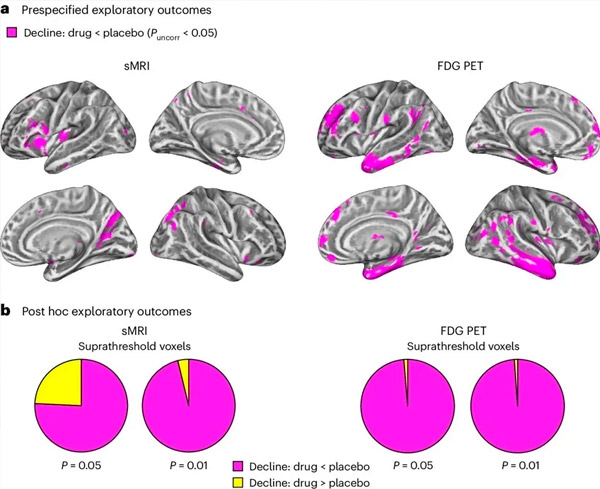
أ. قامت تحليلات النماذج المختلطة المكونة من عاملين للتباين المشترك بفحص التفاعلات بين العلاج (دواء أو دواء وهمي) والوقت (قبل أو بعد العلاج). أظهر تباين t أحادي الاتجاه الذي يفحص فرضية التفاعل (يبطئ الدواء التقدم مقارنةً بالعلاج الوهمي) أن علاج LM11A-31 أدى إلى تباطؤ التنكس الطولي (الألواح اليسرى) ونقص استقلاب الجلوكوز (الألواح اليمنى) في المجموعة المعالجة بالعقاقير (cMRI، n = 127؛ PET، ن = 121)، مقارنة مع مجموعة الدواء الوهمي (sMRI، ن = 66؛ PET، ن = 62). تظهر وحدات Voxels التي تظهر هذا التفاعل عند العتبة غير المصححة P < 0.05 (لون أرجواني) على سطح قشري خاص بالسكان. يظهر نصفي الكرة الأيمن والأيسر في الصفين العلوي والسفلي، على التوالي. تظهر مناطق الدماغ التي تظهر تفاعلات غير متوافقة مع الفرضية في الشكل 7 في البيانات التكميلية. ب. إجمالي عدد وحدات الأكسيل في مناطق الدماغ الإعلانية الضعيفة المحددة مسبقًا (المساحة الإجمالية للمخططات الدائرية) التي تظهر إما تفاعلًا متسقًا مع الفرضية (اللون الأرجواني) أو تفاعلًا غير متسق مع الفرضية (اللون الأصفر) في كل من طرق التصوير (التصوير بالرنين المغناطيسي، اللوحة اليسرى؛ FDG PET، اللوحة اليمنى) عند عتبات P غير المعدلة بشكل متزايد < 0.01 و ف & لتر. 0.05. أظهرت عمليات محاكاة مونت كارلو أن نسب الأكسيل التي تظهر تأثيرات متوافقة مع الفرضية مقابل تلك التي لا تتفق مع الفرضية كانت أعلى بكثير من تلك التي لوحظت من البيانات التي تم إنشاؤها عشوائيًا لكل من cMRI وPET (P < 0.001 لكل طريقة؛ اختبار ثنائي الذيل ).
قلل LM11A-31 بشكل فعال من الزيادة في Aβ42 وAβ40 في CSF مقارنة مع مجموعة الدواء الوهمي. أظهر الدواء أيضًا انخفاضًا في متوسط النسبة المئوية للتغير السنوي في العلامة الحيوية للبروتين قبل المشبكي SNAP25 وانخفاضًا في العلامة الحيوية بعد المشبكي NG، مما يشير إلى تباطؤ في فقدان الاتصالات قبل المشبكي وبعد المشبكي. كما قلل LM11A-31 من نمو YKL40، مما أدى إلى انخفاض درجات MMSE وزيادة درجات ADAS-Cog-13. يقلل الدواء أيضًا من فقدان المادة الرمادية في الفص الجبهي والقشرة الجدارية الخلفية ويقلل من استقلاب الجلوكوز في مناطق مثل القشرة الشمية الداخلية، والقشرة الصدغية، والحصين، والقشرة الجزيرية، وقشرة الفص الجبهي.
الاستنتاج
وخلصت الدراسة إلى أن تعديل p75NTR بواسطة LM11A-31 مناسب للتجارب السريرية الأكبر. استوفى LM11A-31 معيار السلامة الأساسي وكان جيد التحمل من قبل المرضى الذين يعانون من أشكال خفيفة إلى حادة من الربو. تشير النتائج إلى الحاجة إلى مزيد من الدراسات مع فترات علاج أطول لتقييم جدوى استخدام جزيئات صغيرة لتنظيم p75NTR كعلاج معدّل للمرض في مرض الزهايمر. وجدت الدراسة أن LM11A-31 أثر بشكل كبير على العديد من المؤشرات الحيوية، بما في ذلك Aβ40 وAβ42 وSNAP25 وNG وYKL40، مما يشير إلى توهين التطور المرضي. قد تقوم الدراسات المستقبلية بتقييم مؤشرات إضافية للصحة الدبقية.
