منشورات جديدة
البروتين الرئيسي الذي تم تحديده لمنع فقدان كتلة العظام في حالات هشاشة العظام
آخر مراجعة: 02.07.2025

تتم مراجعة جميع محتويات iLive طبياً أو التحقق من حقيقة الأمر لضمان أكبر قدر ممكن من الدقة الواقعية.
لدينا إرشادات صارمة من مصادرنا ونربط فقط بمواقع الوسائط ذات السمعة الطيبة ، ومؤسسات البحوث الأكاديمية ، وطبياً ، كلما أمكن ذلك استعراض الأقران الدراسات. لاحظ أن الأرقام الموجودة بين قوسين ([1] و [2] وما إلى ذلك) هي روابط قابلة للنقر على هذه الدراسات.
إذا كنت تشعر أن أيًا من المحتوى لدينا غير دقيق أو قديم. خلاف ذلك مشكوك فيه ، يرجى تحديده واضغط على Ctrl + Enter.
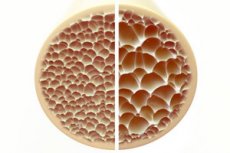
هشاشة العظام، وهي حالة تتميز بعظام مسامية وهشة، تُشكل تهديدًا كبيرًا لصحة الهيكل العظمي. تُوفر العظام، باعتبارها الدعامة الهيكلية الأساسية لجسم الإنسان، دعمًا حيويًا. عندما تنخفض كتلة العظام، لا يقتصر الأمر على إضعاف هذا الدعم فحسب، بل يُضعف أيضًا الوظيفة العامة، مما يؤدي إلى انخفاض جودة الحياة.
مع تزايد انتشار هشاشة العظام بين كبار السن، يزداد العبء على موارد الرعاية الصحية للرعاية طويلة الأمد. لذلك، من الضروري فهم الآليات التي تساهم في تطور هشاشة العظام وتطوير علاجات فعّالة ومستهدفة للحد من آثارها طويلة الأمد.
الخلايا البانية للعظم والخلايا الناقضة للعظم نوعان من الخلايا يلعبان دورًا رئيسيًا في صيانة أنسجة العظام وإعادة تشكيلها. فبينما تُعدّ الخلايا البانية للعظم خلايا مُكَوِّنة للعظم مسؤولة عن تخليق وترسيب أنسجة عظمية جديدة، تُعدّ الخلايا الناقضة للعظم خلايا مُحَلِّلة للعظام، وتُشارك في تفكيك وإزالة أنسجة العظام القديمة أو التالفة.
تؤدي زيادة نسبة الخلايا الناقضة للعظم إلى فقدان العظام في حالات مثل هشاشة العظام، والتهاب المفاصل الروماتويدي (التهاب المفاصل)، ونقائل العظام (سرطان ينتشر إلى العظام). تنشأ الخلايا الناقضة للعظم من تمايز الخلايا البلعمية أو الخلايا الوحيدة، وهي أنواع من الخلايا المناعية.
وبالتالي، قد يُشكّل تثبيط تمايز الخلايا الناقضة للعظم استراتيجية علاجية لمنع فقدان العظام. إلا أن الآليات الجزيئية الدقيقة التي تُنظّم عملية إعادة تشكيل العظام المعقدة لا تزال غير واضحة.
في دراسة جديدة، بحث البروفيسور تادايوشي هاياتا، والسيد تاكوتو كونو، والسيدة هيتومي موراتشي من جامعة طوكيو للعلوم، بالتعاون مع زملائهم، في التنظيم الجزيئي لتمايز الخلايا الناقضة للعظم. يُحفّز تحفيز مُنشّط مستقبلات ربيطة العامل النووي كابا ب (RANKL) تمايز الخلايا البلعمية إلى خلايا ناقضة للعظم.
بالإضافة إلى ذلك، رُبطت مسارات إشارات بروتين تكوين العظام (BMP) وعامل النمو المحول (TGF-β) بتنظيم تمايز الخلايا الناقضة للعظم بوساطة RANKL. في الدراسة الحالية، هدف الباحثون إلى دراسة دور Ctdnep1، وهو إنزيم فوسفاتاز (يزيل مجموعات الفوسفات) أُفيد بأنه يثبط مسارات إشارات BMP وTGF-β.
نُشرت الدراسة في مجلة Biochemical and Biophysical Research Communications.
يقول البروفيسور هاياتا: "يعمل RANKL كمُسرِّع لتمايز الخلايا الناقضة للعظم. قيادة السيارة لا تتطلب مُسرِّعًا فحسب، بل تتطلب أيضًا مكابح. هنا، وجدنا أن Ctdnep1 يعمل كمُكابح لتمايز الخلايا الناقضة للعظم."
قام الباحثون أولاً بفحص تعبير جين Ctdnep1 في الخلايا البلعمية الفأرية المعالجة بـ RANKL وخلايا التحكم غير المعالجة. ولاحظوا أن تعبير جين Ctdnep1 لم يتغير استجابةً لتحفيز RANKL. ومع ذلك، فقد تموضع في السيتوبلازم بشكل حبيبي في الخلايا البلعمية، وتمايز إلى خلايا ناقضة للعظم، وهو ما يختلف عن موضعه الطبيعي حول النواة في أنواع الخلايا الأخرى، مما يشير إلى وظيفته السيتوبلازمية في تمايز الخلايا الناقضة للعظم.
علاوة على ذلك، أدى تثبيط Ctdnep1 (تثبيط التعبير الجيني) إلى زيادة في عدد الخلايا الناقضة للعظم الإيجابية للفوسفاتاز الحمضي المقاوم للطرطرات (TRAP)، حيث يعتبر TRAP علامة على الخلايا الناقضة للعظم المتمايزة.
أدى تعطيل جين Ctdnep1 إلى زيادة التعبير عن علامات التمايز الرئيسية، بما في ذلك "Nfatc1"، وهو عامل نسخ رئيسي يُحفّزه RANKL لتمايز الخلايا الناقضة للعظم. تدعم هذه النتائج دور جين Ctdnep1 في "الكبح"، إذ يُنظّم تمايز الخلايا الناقضة للعظم سلبًا. علاوة على ذلك، أدى تعطيل جين Ctdnep1 أيضًا إلى زيادة امتصاص فوسفات الكالسيوم، مما يُشير إلى دوره الكابت في ارتشاف العظام.
أخيرًا، على الرغم من أن إزالة جين Ctdnep1 لم تُغير إشارات BMP وTGF-β، أظهرت الخلايا التي تعاني من نقص Ctdnep1 مستويات متزايدة من البروتينات المُفسفرة (المُنشَّطة)، وهي نواتج مسار إشارات RANKL. تشير هذه النتائج إلى أن التأثير المثبط لجين Ctdnep1 على تمايز الخلايا الناقضة للعظم قد لا يكون ناتجًا عن إشارات BMP وTGF-β، بل عن طريق تثبيط مسار إشارات RANKL ومستويات بروتين Nfatc1.
بشكل عام، تُقدم هذه النتائج رؤى جديدة حول عملية تمايز الخلايا الناقضة للعظم، وتُحدد أهدافًا علاجية محتملة يُمكن استخدامها لتطوير علاجات للحد من فقدان العظام الناتج عن فرط نشاطها. بالإضافة إلى الأمراض التي تُسبب فقدان العظام، حُدد Ctdnep1 أيضًا كعامل مُسبب لورم الأرومة النخاعية، وهو ورم دماغي يُصيب الأطفال. ويشعر الباحثون بالتفاؤل بإمكانية توسيع نطاق أبحاثهم لتشمل أمراضًا بشرية أخرى تتجاوز استقلاب العظام.
يخلص البروفيسور هاياتا إلى أن: "نتائجنا تشير إلى أن Ctdnep1 ضروري لمنع فرط تكون الخلايا الناقضة للعظم. قد تُوسّع هذه النتائج نطاق معرفتنا بكيفية تحكم شبكة الفسفرة-إزالة الفسفرة في تمايز الخلايا الناقضة للعظم، وقد تُوفر استراتيجيات علاجية جديدة لعلاج أمراض العظام المرتبطة بفرط نشاط الخلايا الناقضة للعظم."
